
- I have forgotten my password

Archivos de Bronconeumologia is a scientific journal that preferentially publishes prospective original research articles whose content is based upon results dealing with several aspects of respiratory diseases such as epidemiology, pathophysiology, clinics, surgery, and basic investigation. Other types of articles such as reviews, editorials, a few special articles of interest to the society and the editorial board, scientific letters, letters to the Editor, and clinical images are also published in the Journal. It is a monthly Journal that publishes a total of 12 issues and a few supplements, which contain articles belonging to the different sections. All the manuscripts received in the Journal are evaluated by the Editors and sent to expert peer-review while handled by the Editor and/or an Associate Editor from the team. The Journal is published monthly in English. Manuscripts will be submitted electronically using the following web site: https://www.editorialmanager.com/ARBR/ , link which is also accessible through the main web page of Archivos de Bronconeumologia. Access to any published article, is possible through the Journal's web page as well as from PubMed, Science Direct , and other international databases. Furthermore, the Journal is also present in Twitter and Facebook. The Journal expresses the voice of the Spanish Respiratory Society of Pulmonology and Thoracic Surgery (SEPAR) as well as that of other scientific societies such as the Latin American Thoracic Society (ALAT) and the Iberian American Association of Thoracic Surgery (AICT). Authors are also welcome to submit their articles to the Journal's open access companion title, Open Respiratory Archives .

Indexed in:
Current Contents/Clinical Medicine, JCR SCI-Expanded, Index Medicus/Medline, Excerpta Medica/EMBASE, IBECS, IME, SCOPUS, IBECS

The Impact Factor measures the average number of citations received in a particular year by papers published in the journal during the two preceding years. © Clarivate Analytics, Journal Citation Reports 2022
CiteScore measures average citations received per document published.
SRJ is a prestige metric based on the idea that not all citations are the same. SJR uses a similar algorithm as the Google page rank; it provides a quantitative and qualitative measure of the journal's impact.
SNIP measures contextual citation impact by wighting citations based on the total number of citations in a subject field.
El diafragma es el principal músculo respiratorio y consta de dos músculos, con una doble inervación y unidos mediante un tendón central. Su contracción producirá un desplazamiento caudal que aumenta el volumen de la caja torácica y genera una presión negativa necesaria para un flujo inspiratorio. La disfunción diafragmática resulta de problemas anatómicos, neuromusculares o biomecánicos que alteran su contracción 1 .
Entre las técnicas para su evaluación el patrón oro es la presión transdiafragmática, invasiva, incapaz de discriminar entre afectación uni- o bilateral y de escaso uso en la práctica clínica habitual. Otras, como las presiones (PIM o SNIP), o la capacidad vital en supino son no invasivas y sencillas, pero poco sensibles. Tampoco discriminan la naturaleza uni- o bilateral de la afectación. Entre las técnicas de imagen están las «clásicas» como la radioscopia (poco sensible si la afectación es bilateral) y herramientas de gran complejidad como la cinetomografía computarizada o la cinerresonancia magnética, que muestran el movimiento tridimensional y contenido muscular, pero con elevado coste y complejidad, por tanto poco prácticas para la evaluación rutinaria diafragmática 2 .
En los últimos años, el desarrollo de la ecografía diafragmática ha supuesto una revolución, ya que permite evaluar de forma bilateral la morfología y función diafragmáticas en tiempo real, permite el seguimiento sin exposición a la radiación, siendo asequible y ubicua.
Se han propuesto varios métodos para evaluar la movilidad diafragmática desde la primera descripción por parte de Haber en 1975 3 , que en la actualidad se resumen en dos: el desplazamiento de la cúpula, y el engrosamiento muscular 4,5 .
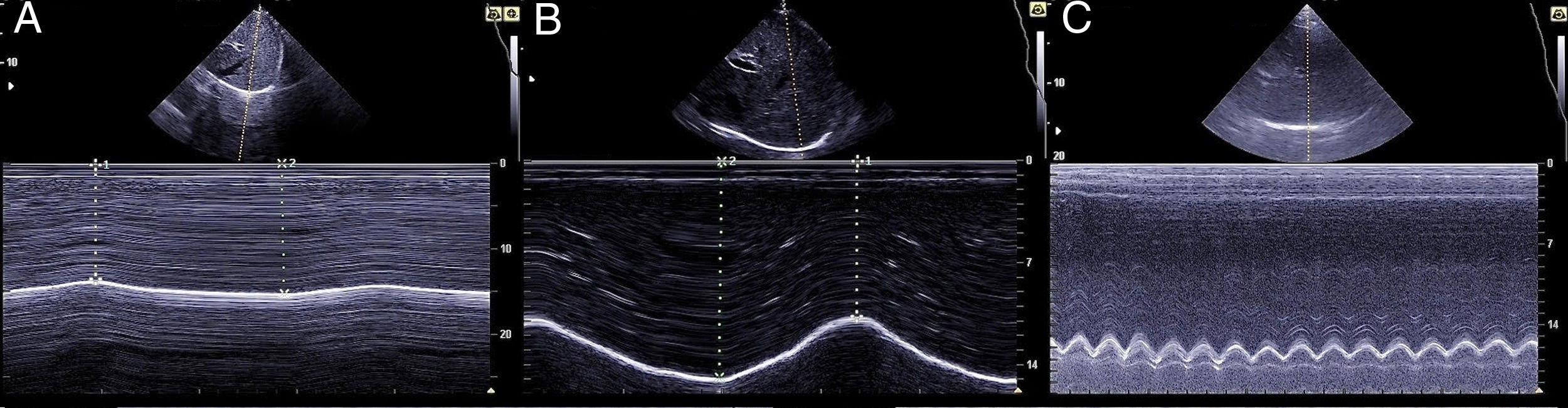
La medición del desplazamiento evalúa la capacidad del diafragma de generar cambios de volumen en la caja torácica. Se realiza un abordaje subcostal , usando una sonda convexa de baja frecuencia a nivel de la línea medio clavicular, buscando el tercio posterior de la cúpula diafragmática en el lado derecho, a través de la ventana hepática. En el lado izquierdo se utiliza la ventana esplénica, pero la cúpula es más difícil de localizar, especialmente si hay interposición de vísceras abdominales 6 . Una alternativa es el abordaje lateral , colocando la sonda en posición perpendicular en los espacios intercostales inferiores a nivel de la línea medio axilar. Tras la localización de la cúpula en «modo 2D», el modo ecográfico «M anatómico» facilita la identificación de la porción de la cúpula con mayor movilidad, para su medición en un corte sagital. Se mide el desplazamiento en respiración en reposo (volumen corriente), en inspiración y espiración profundas (capacidad vital) o en maniobras de sniff ( fig. 1 ). Puede medirse también su potencia (desplazamiento a lo largo del tiempo, en forma de pendiente de la curva de desplazamiento). En algunas situaciones en las que no se discrimina adecuadamente el diafragma, se puede medir el desplazamiento de vísceras abdominales (vena cava en el lado derecho, o del bazo en el izquierdo), con aceptables resultados. Esto se conoce como «método indirecto» 7 .
La medición del grosor diafragmático es otro método actualmente empleado, permite determinar la masa muscular diafragmática, y valorar la fracción de engrosamiento, o «thickening fraction» (TF) . Para esta medición se utiliza una sonda lineal de alta frecuencia, colocada entre los últimos espacios intercostales. De esta forma se localiza la «zona de aposición», donde el diafragma se inserta en la pared costal. El diafragma se identifica como la franja hipoecogénica limitada por dos líneas hiperrefringentes, que corresponden a la pleura y al peritoneo. El TF es la relación entre el grosor en reposo (capacidad residual funcional) y en máxima inspiración (capacidad vital) ( figs. 1 y 2 ).
Cúpula diafragmática en modos «2D» y «M anatómico» y mediciones de desplazamiento de la cúpula en A) desplazamiento en volumen corriente, B) desplazamiento en capacidad vital, C) maniobras de sniff.
Diafragma en zona de aposición y medición de grosor, 2A) capacidad residual funcional, 2B) capacidad vital.
Para ambas mediciones se han propuesto valores normales por distintos autores 6,8 .
Estas medidas tienen una serie de aplicaciones prácticas muy relevantes. Una de las más estudiadas es la predicción del éxito en la retirada de la ventilación mecánica en pacientes críticos : un TF > 30% se asocia a un mayor éxito en el weaning , mientras que uno 4 .
La ecografía en la evaluación del paciente neuromuscular es prometedora en patologías con especial predilección por el diafragma, como las glucogenosis o las miopatías mitocondriales. Es útil en pacientes cuya afectación bulbar impide la realización de pruebas funcionales respiratorias tradicionales. En concreto, ha demostrado ser un predictor de hipoventilación en pacientes con ELA 2,9 , aunque discutida por otros autores 10 .
En el paciente con EPOC se ha propuesto el uso de la ecografía diafragmática para evaluar el efecto de la rehabilitación sobre el diafragma 11 , y está descrita como predictor de éxito de la ventilación mecánica no invasiva en pacientes con exacerbaciones graves 12 .
También tiene utilidad en la detección y seguimiento de la disfunción diafragmática postoperatoria de cirugías que pueden cursar con lesiones frénicas, como la cardiaca o la torácica. Se puede valorar la indemnidad del nervio frénico mediante la estimulación de su trayecto cervical, observando la respuesta en desplazamiento y engrosamiento diafragmático.
En otras aplicaciones, como la titulación de los umbrales de estimulación de un marcapasos frénico, la ecografía diafragmática podría sustituir técnicas más invasivas, como el uso de la presión diafragmática transesofágica 13 .
Sin embargo, en nuestra opinión, existen todavía algunas limitaciones que lastran su desarrollo. La ausencia de valores estandarizados de normalidad, basados en grandes poblaciones (como lo son las ecuaciones predictivas de la espirometría), la variabilidad en las mediciones en función de la postura, ubicación del transductor, etc. han limitado su generalización. Otras cuestiones, como la necesidad de establecer un periodo previo de ventilación espontánea antes de evaluar el TF en pacientes sometidos a ventilación mecánica, deben tenerse en cuenta a la hora de usar esta técnica. Incluso al desconectar a ventilación espontánea, es posible que la fatiga muscular tarde algunos minutos en manifestarse, para poder ser evaluada 14 .
La ecografía diafragmática es una técnica cuyo desarrollo en la Neumología moderna la llevará a ser otra herramienta más en el arsenal diagnóstico del neumólogo. Su rápida implantación también obedece a la facilidad para obtener experiencia en su uso, con una rápida curva de aprendizaje 15 . Unido a la disponibilidad ubicua de ecógrafos, su uso a pie de cama, y las mejoras tecnológicas futuras, hacen de ella una pieza añadida en la evaluación funcional muscular respiratoria. Para generalizar más aún su uso, deberán estandarizarse los valores normales con grandes cohortes, protocolizar la técnica de medición y definir de forma más precisa su sensibilidad/especificidad en distintas patologías.
Javier Sayas reconoce honorarios por tareas docentes relacionadas con la ventilación mecánica por parte de Chiesi, ResMed, Philips, Mundipharma. Es el investigador principal de un proyecto financiado parcialmente por Menarini, y es investigador asociado de un proyecto que incluye el uso de ecografía diafragmática financiado por Sanofi.
Ana Hernández-Voth es la investigadora principal de un proyecto financiado por Sanofi, y ha recibido honorarios por actividades docentes de Chiesi.
Victoria Villena reconoce honorarios por tareas docentes por parte de Menarini.
Los autores quieren agradecer al Dr. Borja de la Quintana Gordon su dedicación docente y colaboración.
- Subscribe to our newsletter
- Clinical Characteristics and 2-Year Outcomes of Chronic Obstructive Pulmonary Disease Patients With High Blood Eosinophil Counts: A Population-based Prospective Cohort Study in China
- Potential Benefits of a Cardiovascular Polypill in Long COVID Patients
- Multidisciplinary Consensus on the Management of Non-Invasive Respiratory Support in the COVID-19 Patient
- Hypersensitivity Pneumonitis-like Histological Findings Secondary to SARS-COV-2 Pneumonia
- Send to a friend
- Export reference

- Instructions for authors
- Submit an article
- Ethics in publishing

Archivos de Bronconeumología follows the Recommendations for the Conduct, Reporting, Editing and Publication of Scholarly Work in Medical Journals
- Articles in press
- Current Issue
- Supplements
- Covers gallery
- Related journal - Open Respiratory Archives
- Open Access Option
- Language Editing services
- Aims and scope
- Editorial Board
- Advertising
- Most often read
- Most popular
- All metrics
Are you a health professional able to prescribe or dispense drugs?
An official website of the United States government
The .gov means it’s official. Federal government websites often end in .gov or .mil. Before sharing sensitive information, make sure you’re on a federal government site.
The site is secure. The https:// ensures that you are connecting to the official website and that any information you provide is encrypted and transmitted securely.
- Publications
- Account settings
Preview improvements coming to the PMC website in October 2024. Learn More or Try it out now .
- Advanced Search
- Journal List
- Rev Fac Cien Med Univ Nac Cordoba
- v.78(2); 2021 Jun 28

Language: Spanish | English | Portuguese
Disfunción diafragmática asociada a la ventilación mecánica invasiva en pacientes adultos críticamente enfermos
Diaphragmatic dysfunction associated with invasive mechanical ventilation in critically ill adult patients, disfunção diafragmática associada à ventilação mecânica invasiva em pacientes adultos críticos, pablo tocalini.
1 Clínica Basilea, CABA Argentina
Antonela Vicente
2 Hospital General de Agudos Parmenio Piñero, CABA Argentina
Juan Manuel Carballo
3 Hospital General de Agudos Donación Francisco Santojanni, CABA Argentina
Luis Ignacio Garegnani
4 Centro Cochrane Asociado Instituto Universitario Hospital Italiano, CABA Argentina
La ventilación mecánica invasiva (VMI) es una terapia de soporte vital que no está exenta de complicaciones, como la disfunción diafragmática inducida por la ventilación mecánica, que se caracteriza por atrofia y debilidad de dicho musculo. El interés en esta patología parece estar basado en la asociación encontrada con resultados clínicos negativos. La prevalencia oscila entre 29% y 80%, probablemente debido a la variabilidad entre los diferentes métodos diagnósticos y el momento de la evaluación. El patrón de oro continúa siendo la presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos, aunque por la falta de practicidad, se comenzó a utilizar la ecografía diafragmática. Si bien cuenta con varias modalidades, no todas tienen análisis de correlación con el patrón de oro. Otra problemática surge al momento de analizar la asociación independiente entre la patología y la VMI, ya que los factores de confusión no son sencillos de aislar.
Invasive mechanical ventilation (VMI) is a life support therapy that is not free of complications, such as ventilator induced diaphragmatic dysfunction, which is characterized by atrophy and weakness of the muscle. Interest in this pathology seems to be based on the association found with negative clinical results. The prevalence ranges between 29% and 80%, probably due to the variability between the different diagnostic methods and the time of evaluation. The gold standard continues to be the transdiaphragmatic negative pressure generated by the bilateral stimulation of the phrenic nerves, although due to the lack of practicality, diaphragmatic ultrasound began to be used. Although it has several modalities, not all of them have correlation analysis with the gold standard. Another problem arises when analyzing the independent association between pathology and VMI, since confounding factors are not easy to isolate.
A ventilação mecânica invasiva (VMI) é uma terapia de suporte de vida que não apresenta complicações, como disfunção diafragmática induzida por ventilação mecânica, caracterizada por atrofia e fraqueza do referido músculo. O interesse por essa patologia parece basear-se na associação encontrada com resultados clínicos negativos. A prevalência varia de 29% a 80%, provavelmente devido à variabilidade entre os diferentes métodos de diagnóstico e o tempo de avaliação. O padrão ouro continua sendo a pressão negativa transdiafragmática gerada pela estimulação bilateral dos nervos frênicos, embora, devido à falta de praticidade, o ultra-som diafragmático tenha começado a ser utilizado. Embora tenha várias modalidades, nem todos têm análises de correlação com o padrão-ouro. Outro problema surge ao analisar a associação independente entre patologia e IMV, uma vez que fatores de confusão não são fáceis de isolar.
Las personas internadas en la Unidad de terapia intensiva, muchas veces requieren estar conectadas a un respirador artificial, mientras se resuelve la enfermedad. Sin embargo estar conectados al respirador tiene sus consecuencias, dentro de las cuales se encuentra la disfunción diafragmática inducida por la ventilación mecánica. Esta entidad se caracteriza por afectar al principal músculo de la respiración, el diafragma, generándole debilidad, lo cual tiene impacto significativo a la hora de querer separar al paciente del respirador artificial. El mejor método para diagnosticarla continúa siendo la presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos, aunque por la falta de practicidad, se comenzó a utilizar la ecografía diafragmática. Tanto los datos como las repercusiones de esta patología todavía no son del todo claros.
Conceptos clave
Qué se sabe sobre el tema:.
La disfunción diafragmática inducida por la ventilación mecánica es una entidad de reciente definición y de interés creciente, que se caracteriza por la atrofia y la disfunción contráctil del diafragma. El interés sobre esta patología recae en la asociación con resultados clínicos negativos como mayor duración de la VMI, falla en el destete y mayor mortalidad.
Qué se aporta con el trabajo:
Si bien es una patología con impacto clínico significativo sobre los pacientes en VMI, se puede ver que todavía hay heterogeneidad en los valores de referencia y en los métodos diagnósticos utilizados. Así también muchos de los trabajos analizados no estaban diseñados ni potenciados para hallar relación entre la DDIVM y variables clínicas. Todo esto se pone de manifiesto en la variabilidad de los resultados que presentan los trabajos analizados.
Introducción
La ventilación mecánica invasiva (VMI) es una terapia de soporte vital, cuya utilización fue en aumento 1 . Alrededor del 40% de los pacientes requieren ventilación mecánica (VM) durante la internación en la unidad de cuidados intensivos (UCI) 2 y entre un 10% al 15% la requerirán de manera prolongada 3 . Una de las etapas más importantes de su implementación es el destete, que abarca hasta un 40% del tiempo total de internación en UCI 2 , 4 y en la que se observa que entre un 20% al 40% de los pacientes presentan dificultades para interrumpir el uso de esta terapéutica 4 . Esto implica, mayor tiempo en VMI y mayor estadía en UCI, asociándose a mayores costos 1 y mayor morbimortalidad 1 , 5 .
Si bien la VMI es una terapéutica de soporte vital, no está exenta de complicaciones 6 , que tienen impacto sobre el destete y pueden comenzar en las primeras horas tras la implementación del soporte ventilatorio 7 , 8 . Si bien se han descripto múltiples complicaciones relacionadas con la VMI, algunas parecen ser difíciles de reconocer clínicamente, lo cual lleva al subdiagnóstico de entidades 9 , como la atrofia y lesión de las fibras musculares 10 . Esto conduce al desarrollo de debilidad adquirida en la unidad de cuidados intensivos (DAUCI), cuyo principal enfoque es la disfunción de los músculos estriados de las extremidades 11 . El diafragma también se ve afectado, incluso en menor tiempo 12 . Éste es el músculo principal de la ventilación 13 , por lo que su correcto funcionamiento tiene un gran impacto en el destete de la VMI 14 , 15 .
Durante el período inicial de la enfermedad crítica, uno de los objetivos de la implementación de la VM es la puesta en reposo de los músculos respiratorios, que permanecen en desuso, generando acortamiento pasivo y menor requerimiento energético 1 , pudiendo dar paso a lo que se conoce como disfunción diafragmática inducida por la ventilación mecánica (DDIVM), término inicialmente descripto por Vassilakopoulos y Petro f 16 . Esta entidad puede ser definida como la pérdida de la capacidad de generación de fuerza, por parte del diafragma, relacionada con el uso de la VM 3 y se caracteriza por la atrofia y la disfunción contráctil de dicho músculo 17 . La prevalencia reportada oscila entre 29% 13 y 80% 18 probablemente debido a los diferentes métodos diagnósticos, así como también al momento de la evaluación. El interés sobre las características de esta entidad recae en la asociación con resultados clínicos negativos, como mayor duración de la VMI, falla en el destete y mayor mortalidad 19 .
La medición de la presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos (TwPdi, del inglés "twitch transdiaphragmatic pressure" ), continúa siendo el patrón de oro para diagnosticarla, aunque por mayor practicidad de implementación, se comenzó a utilizar la ecografía diafragmática (ED) 19 , 20 . Si bien esto supone un avance para la detección y el seguimiento, acarrea problemas, ya que solo algunos de los métodos de ED tienen análisis de correlación con el patrón de oro 19 y tampoco hay un punto de corte establecido de horas de VMI a partir de la cual se considere que la disfunción diafragmática (DD) es generada sólo por la VMI y no por la combinación de otros factores como por ejemplo la presencia de sepsis 21 . Cuando se analiza histológicamente al diafragma, en donantes de órganos, se puede tener cierto control sobre la ausencia de sepsis 22 . Esto se dificulta cuando evalúan poblaciones generales y es aquí donde la asociación independiente entre DD y VMI se vuelve problemática. Es por ello que el objetivo de este trabajo fue revisar la literatura relacionada con la DDIVM, sus características clínicas, sus métodos diagnósticos y su impacto sobre las principales variables de resultado en la UCI.
Materiales y Métodos
Estrategia de búsqueda.
Se realizó una búsqueda bibliográfica en la base de datos Medline y Cochrane Library el 20 de Febrero de 2019. Debido a la falta de término Mesh (en Pubmed) para DDIVM, se utilizaron los términos "VIDD", "ventilator-induced diaphragm dysfunction", "diaphragmatic injury induced by mechanical ventilation" y "Diaphragm dysfunction" combinados entre sí con el operador booleano "OR" y estos con las palabras claves para VMI "Respiration, Artificial", "Artificial Respiration" y "Mechanical Ventilation". Se aplicó también el truncado de palabra y la búsqueda por título y resumen. A su vez se realizó la búsqueda manual en las referencias bibliográficas de los estudios incluidos y revisiones literarias publicadas.
Criterios de selección
Se incluyeron aquellos trabajos publicados en inglés y español, realizados en pacientes adultos (mayores de 18 años), internados en UCI, con requerimiento de VMI vía intubación orotraqueal, que evalúen métodos diagnósticos para DD y/o informen variables de resultado en estos pacientes.
En Medline la búsqueda arrojó 859 trabajos. Luego de revisar por título y resumen se excluyeron 780, por no tener resultado de interés, por idioma diferente al inglés o español, por ser protocolos o por estar realizados en animales o niños. De los restantes, luego de la revisión por texto completo, se seleccionaron 18 estudios para la confección del presente texto, de los cuales 2, fueron incorporados luego de revisar manualmente las referencias bibliográficas ( Figura 1 ).

En Cochrane Library la búsqueda arrojó 73 trabajos. Después de revisar por título y resumen, todos fueron excluidos, por no tener resultado de interés, por idioma diferente al inglés o español, por ser protocolos, por estar realizados en animales o niños o por haber sido incluidos en la búsqueda en Medline.
EPIDEMIOLOGÍA
La prevalencia reportada sobre DDIVM es variable, desde 29% 13 a 80% 18 ( tabla 1 ). Esto podría deberse a la variabilidad en las poblaciones estudiadas, el momento del registro, la herramienta diagnóstica utilizada así como también el punto de corte seleccionado para establecer el diagnóstico y los días en VMI previos a la evaluación.
TQT: traqueostomía; IOT: intubación orotraqueal; VE: ventilación espontánea; VMI: ventilación mecánica invasiva; Dg: diagnóstico; PVE: prueba de ventilación espontánea; PC-CSV: presión de soporte; T-T: tubo T; EXdi: excursión diafragmática; Ptr,Stim: cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos; TwPdi: presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos; TFdi: fracción de engrosamiento diafragmático; Tdi: engrosamiento diafragmático.
Varios autores informaron la prevalencia en relación al destete. Algunos antes de realizar la primera prueba de ventilación espontánea (PVE) 13 , 23 , otros durante la realización de la misma 4 , 18 , 24 , 25 y Laghi et al 26 la informó en pacientes que fallan la PVE. A su vez, varios autores la informaron en relación al tiempo transcurrido en VMI 12 , 15 , 19 , 27-29 .
Día de la prueba de ventilación espontánea
Antes de la pve.
Dres et al 23 observó una prevalencia de 63% y Kim et al 13 del 29%. Esta diferencia puede estar relacionada por un lado, al método diagnostico, ya que Dres et al 23 utilizó el cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos (Ptr,Stim, del inglés "changes in endotracheal tube pressure induced by bilateral phrenic nerve stimulation during airway occlusion" ) para la valoración de la DD y Kim et al 13 la excursión diafragmática (EXdi, del inglés "diaphragm excursion" ), evaluada por ED. Por otro lado, también puede deberse a la población analizada, ya que Kim et al 13 excluyó a todos los pacientes con DD previa al inicio del estudio.
Durante la PVE
Mariani et al 25 informó un 38%, Huang et al 4 un 75%, Lu et al 24 un 34% y Jung et al 18 un 80%. Son evidente las diferencias entre los estudios y la comparación resulta dificultosa ya que las poblaciones, la forma de realizar la PVE, el tiempo de duración de la misma, así como también la herramienta diagnóstica difieren entre ellos.
Huang et al 4 , utilizando la EXdi, incluyó pacientes mayores a 80 años con varias comorbilidades, lo cual podría explicar la elevada tasa de DD. Jung et al 18 , utilizando Ptr,Stim, también informó una tasa elevada de DD, la cual se puede explicar porque incluyó sólo pacientes con diagnóstico previo de DAUCI y la prevalencia se calculó a los 60 minutos de comenzada la PVE. Al analizar el trabajo de Lu et al 24 , quien utilizó la fracción de engrosamiento diafragmático (TFdi, del inglés "diaphragm thickening fraction" ) para valorar la DD, observamos que si bien eran pacientes que cumplían con los criterios de destete prolongado y se podría considerar que tienen mayor debilidad muscular, se excluyó a los pacientes con DD previa. Además, el punto de corte que consideró para el diagnóstico, era menor al que según Dubé et al 19 tiene buena correlación con Ptr,Stim. Esto podría explicar la menor tasa de DD. Algo parecido sucedió en el trabajo de Mariani et al 25 . Solo incluyó pacientes con más de 7 días de VMI, que completaran exitosamente la PVE, tal vez excluyendo a un gran número de pacientes que no lograron completar la PVE pero que sí podrían tener DD.
Después de la PVE
Laghi et al 26 informó una prevalencia de 66% en pacientes que fallaban la PVE, siendo el único autor que la informó en este momento.
A las 24 horas de intubación orotraqueal y ventilación mecánica invasiva
Demoule et al, en 2013 27 y 2016 28 , y Dubé et al 19 en 2017 informaron la incidencia de DD a las 24 hs de VMI, reportando 64%, 53% y 77% respectivamente. La edad y el score de gravedad en los tres trabajos eran similares. Si bien los pacientes fueron evaluados dentro de las primeras 24 hs de VMI, hay evidencia que el diafragma muestra signos de lesión en tan solo 18 hs de VMI 22 , por lo que esta disfunción podría ser causa de ella, aunque también de la sepsis al ingreso a la UCI, debido a la alta prevalencia reportada 19 , 27 .
Demoule et al, explicó la diferencia entre sus cohortes, basándose en la del 2016, si bien fueron evaluados a las 24 hs de VMI, sólo se incluyeron pacientes con más de 5 días de VMI, por lo que los pacientes más graves probablemente podrían haber muerto antes de ser incluidos y por eso la incidencia de DD puede ser menor 27 , 28 .
Más de 24 horas de intubación orotraqueal y ventilación mecánica invasiva
Grosu et al 3 informó, utilizando como diagnóstico el engrosamiento diafragmático (Tdi, del inglés "diaphragm thickness" ), que a las 72 hs disminuyó en el 84% de los pacientes. Sin embargo no informó el porcentaje de cambio en el grosor respecto del basal, lo cual lo vuelve incomparable con las otras cohortes.
Goligher et al, en 2015 15 y 2018 29 consideró un Tdi menor al 10% del basal como punto de corte para determinar DD. En el 2018 29 informó que el Tdi disminuía al menos un 10% en el 41% de los pacientes y 44% en la cohorte del 2015 15 . La diferencia podría estar relacionada al momento de re-evaluación, ya que la prevalencia en el estudio de 2018 se informó a los 4 días de VMI y en el 2015 a la semana 15 , 29 , ya que la edad y el score de gravedad en ambas fueron similares. Schepens et al 12 informó una caída del Tdi de al menos 10% en el 77% de los pacientes en el día de la traqueostomía (TQT), extubación, retorno a la ventilación espontánea sin asistencia o muerte. La diferencia es notable con respecto a las cohortes de Goligher et al 15 , 29 , sin embargo Schepens et al no informa los días de VMI previos al momento de la reevaluación y la media de SAPS II fue superior a lo reportado por otros autores 12 ,15 , 29 .
DIAGNÓSTICO
Se han utilizado varios métodos (invasivos y no invasivos) para evaluar la fuerza y/o función del diafragma y llegar así al diagnóstico de DD ( tabla 2 ).
Dg: diagnóstico; DD: disfunción diafragmática; EXdi: excursión diafragmática; Ptr,Stim: cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos; TwPdi: presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos; TFdi: fracción de engrosamiento diafragmático; Tdi: engrosamiento diafragmático; Pimax: Presión inspiratoria estática máxima. H: hombres; M: mujeres.
Métodos invasivos
Medición de la presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos (twpdi).
El patrón de oro para valorar la fuerza diafragmática es la TwPdi 30 , que requiere de un catéter esofágico y uno gástrico más los elementos de estimulación nerviosa. Es un método que requiere personal calificado, consume tiempo y no es práctico para el uso diario 19 , 31 . Se calcula con la fórmula TwPdi: ∆ presión gástrica - ∆ presión esofágica (∆: diferencia entre la presión previa a la estimulación y el pico de presión alcanzado luego de la estimulación) 9 .
Esta técnica fue utilizada por primera vez por Watson et al 30 en pacientes internados en UCI, desarrollando una técnica que podía ser aplicada sin la necesidad de esfuerzo voluntario y por lo tanto en pacientes sedados. Más allá de la dificultad práctica, algunos estudios la utilizaron como método 26 , 32 . Según Laghi et al 26 el valor normal de en sujetos sanos va de 35.4 a 38.9 cmH2O mientras que en su cohorte aquellos que fallaron el destete tenían menos de 10 cmH2O, similar a lo encontrado por Hermans et al 32 .
Medición del cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos (Ptr,Stim)
También utilizada por primera vez por Watson et al 30 , quien intentó correlacionarlo con la Ptr,Stim, encontrando correlación positiva muy fuerte, por lo que en varios trabajos posteriores fue considerado como el patrón de oro 19 , 27 . Si bien no requiere del balón gástrico y esofágico, si necesita del instrumental para la estimulación eléctrica, ya que se calcula como el diferencial de presión a nivel del tubo orotraqueal antes y después de la estimulación del nervio frénico 30 . Los estudios que la utilizan toman un valor menor a 11 cmH2O para determinar DD 18 , 19 , 23 , 27 , 28 , basándose en la recomendación de la Sociedad americana de tórax y Sociedad europea respiratoria 33 . Este valor fue validado por Demoule et al 27 en una población de pacientes anestesiados por un período corto de tiempo para la realización de cirugías electivas.
Métodos no invasivos
Presión inspiratoria estática máxima.
Es una forma simple, rápida y fácil de medir la fuerza de los músculos inspiratorios 33 y aunque mostró tener una buena correlación con la Ptr,Stim 18 , no evalúa al diafragma de forma aislada 33 , sino que debe interpretarse como una evaluación global de los músculos inspiratorios 18 , motivo por el cual no es utilizada por los estudios para el diagnóstico de DD.
Ecografía diafragmática (ED)
La evaluación al lado de la cama del diafragma no es algo fácil 31 . La ED es una técnica precisa, segura y fácil de implementar al lado de la cama y hace unos años se ha comenzado a utilizar para la evaluación del diafragma en la UCI 20 , 34 . Si bien tiene limitaciones, como la dificultad para encontrar una buena ventana para evaluar, mostró tener buena correlación intra e inter-observador 34 , 35 y puede ser utilizada para la evaluación funcional y morfológica del diafragma e incluso puede implementarse de manera práctica para repetir mediciones a lo largo del tiempo 20 y valorar diversos parámetros de la actividad diafragmática.
Engrosamiento diafragmático (Tdi)
Se define como la distancia desde la parte media de la pleura diafragmática hasta la parte media de la pleura peritoneal evaluado al final de la espiración en la zona de aposición del diafragma 2 , 10 , 34 . Baldwin et al 36 hace referencia que esta técnica es precisa, fácil de realizar y que es fiable para la medición en pacientes en posición reclinada. Según Goligher et al 31 el Tdi puede utilizarse para evaluar la variación del engrosamiento del diafragma en pacientes con VMI, por lo que podría detectar fiablemente atrofia diafragmática y evaluar la función contráctil sin que ese engrosamiento refleje el inflado pasivo del tórax. Sin embargo Dubé et al 19 , pone en duda esta utilidad del Tdi y sugiere no utilizarlo como estimador de la contracción de este músculo, por lo menos en el ámbito de la UCI, al encontrar correlación débil con la Ptr,Stim. También refiere que el aumento del grosor podría representar un problema patológico y no un incremento de la masa muscular funcional. La mayoría de los autores que utilizan el Tdi, informan que un descenso en el engrosamiento con respecto al basal se relaciona con DD 2 , 3 , 12 , 15 , 29 e incluso algunos 15 , 29 utilizan como punto de corte un descenso del Tdi mayor o igual al 10% del basal como determinante de esto.
Fracción de engrosamiento diafragmático (TFdi)
Se calcula utilizando el ecógrafo en modo M para obtener las variables y aplicarlas en la fórmula: TFdi: (Grosor al final de la inspiración – Grosor al final de la espiración)/ Grosor al final de la espiración 34 . El valor normal en voluntarios sanos oscila entre 30-40% 31 . Goligher 31 plantea utilizarla solo para la valoración cualitativa de la actividad muscular inspiratoria. Sin embargo Dubé et al 19 , demuestra que hay correlación positiva muy fuerte entre la TFdi y Ptr,Stim y que puede detectar DD en el momento que el paciente tolera PC-CSV. Con respecto a los estudios que lo toman en cuenta 7 , 10 , 15 , 18 , 19 , 23 , 24 , algunos establecen puntos de corte para determinar el diagnóstico de DD.
Lu et al 24 y Jung et al 18 establecen como punto de corte una TFdi < 20% y Zambon et al 10 lo utiliza como variable para evaluar la actividad diafragmática en pacientes con diferentes niveles de soporte ventilatorio. Por su parte Dres et al, en el 2017 23 y 2018 7 utiliza a la TFdi como variable para valorar la asociación con resultados clínicos, encontrando que una TFdi < 25.8% es buen predictor de falla en el destete 7 .
Excursión diafragmática (EXdi)
La utilización de la EXdi como índice de la función diafragmática debe ser limitada a pacientes que ventilen espontáneamente. Para evaluarla es mejor utilizar el modo ecográfico M 20 .
El valor normal en pacientes sanos es de 18 ± 3 mm en hombres y 16 ± 3 mm en mujeres 34 mientras que para diagnosticar DD los puntos de corte reportados van de 10 a 14 mm en ventilación espontánea tranquila 20 . Según Dubé et al 19 la EXdi depende del grado de contracción activa y desplazamiento pasivo del diafragma generado por el ventilador. Kim et al 13 toma un punto de corte menor a 10 mm para diagnosticar DD, el cual fue algo arbitrario ya que no había hasta ese momento valores normales en pacientes ventilados.
Dres et al 23 evalúa la EXdi previo a la realización de la PVE sin establecer un punto de corte para detectar DD, sino que intenta ver si se comporta como predictor de destete. Dubé et al 19 reporta correlación débil entre Ptr,Stim y EXdi al inicio de la VMI (evaluación dentro de las 24 hs de VMI) y correlación media entre las mismas variables al momento que el paciente tolera PC-CSV una hora. Al mismo tiempo, evalua la precisión diagnóstica del Exdi para DD y encuentra que tanto al inicio de la VMI como al momento de pasar a PC-CSV no puede identificar de forma fiable la DD 19 .
VARIABLES DE RESULTADO
Con el objetivo de analizar el impacto de la DD sobre las distintas variables de resultados de los pacientes, se seleccionaron los trabajos que describen dichas variables ( tabla 3 ).
n: tamaño muestral; UCI: unidad de cuidados intensivos; VMI: ventilación mecánica invasiva; Dg: diagnóstico; Qx: quirúrgica; DE: departamento de emergencia; PVE: prueba de ventilación espontánea; PC-CSV: presión de soporte; EXdi: excursión diafragmática; Ptr,Stim: cambio en la presión a nivel del tubo orotraqueal generada por la estimulación bilateral de los nervios frénicos; TwPdi: presión negativa transdiafragmática generada por la estimulación bilateral de los nervios frénicos; TFdi: fracción de engrosamiento diafragmático; Tdi: engrosamiento diafragmático; DD: disfunción diafragmática; FOM: falla orgánica múltiple.
Kim et al 13 encontró que los pacientes con DD tenían mayor tasa de falla primaria y secundaria de destete, así como también mayor cantidad de horas de VMI, mayor tiempo de destete, mayor estadía en UTI y hospitalaria. Sin embargo, no encontró diferencia en cuanto a la mortalidad hospitalaria entre los pacientes con DD y aquellos sin DD. Los pacientes no tenían diferencia en cuanto a la edad entre los grupos, pero no informaron ningún score de gravedad, que nos permita tener una idea del estado crítico de los pacientes evaluados.
Demoule et al 27 encontró que los pacientes con DD a las 24 hs de ingreso presentaban mayor mortalidad tanto en UCI como en el hospital, sin diferencias entre los grupos en cuanto a duración de la VMI, tasa de TQT y estadía tanto en UCI como en el hospital. Los pacientes con DD eran mayores, tenían mayor prevalencia de sepsis al ingreso a la UCI y estaban más graves que aquellos que no tenían DD, estas últimas dos variables con diferencias estadísticamente significativas entre los grupos. En base a esto se plantea si la DD podría ser una expresión más de la falla multiorgánica. Con respecto a la influencia de la VMI sobre la DD, si bien el tiempo de evaluación fue corto, no pueden descartar su influencia sobre la DD. No hay que dejar de lado que queda por establecer si existe relación causal entre la mortalidad y la DD ya que el estudio no estaba potenciado con tal objetivo.
Supinski et al 9 encontró que los pacientes con una TwPdi < 10 cmH2O tenían mayor mortalidad en UCI, requerían más del doble de tiempo para el destete y mayor duración de VMI posterior a la evaluación con respecto a los que tenían una TwPdi ≥ 10 cmH2O. Esta diferencia parecería deberse solo a la debilidad diafragmática ya que los score de gravedad eran similares entre los dos grupos. Sin embargo, no encontraron asociación entre el valor de TwPdi y los días de VMI previo a la evaluación. A su vez los pacientes sin evidencia de infección tenían valores más bajos de TwPdi que los pacientes sanos (13 cmH2O Vs 30 cmH2O), lo que podría deberse a la acción de la VMI.
Mariani et al 25 encontró que los pacientes con DD tenían mayor mortalidad en UCI respecto al subgrupo sin DD, pero no así con respecto a la mortalidad hospitalaria (1 de 21 Vs 4 de 13). En relación a los pacientes con DD bilateral se observó una tendencia a mayor duración de VMI y estadía en UCI. Ninguno de los pacientes con DD falló la extubación, sin embargo, hay que interpretar con cautela este dato, dado que el estudio no estaba potenciado para tal fin. Con respecto a las variables demográficas, no encontraron diferencia en cuanto a la edad entre los pacientes sin DD y aquellos con DD unilateral y solo una tendencia a mayor edad con respecto a los pacientes con DD bilateral. Si hallaron diferencia en cuanto a la falla multiorgánica, ya que la desarrollaban el 100% de los pacientes con DD bilateral y solo el 52% sin DD.
Demoule et al 28 encontró que los pacientes con DD presentaban mayor mortalidad en UCI, no encontrando diferencias en cuanto a duración de VMI, mortalidad hospitalaria, estadía en UCI y en el hospital. Con respecto a las variables demográficas, los grupos no diferían en cuanto a la edad, SAPS II ni porcentaje de sepsis en la admisión a UCI.
Jung et al 18 encontró que la TFdi se asociaba con éxito de extubación. Sin embargo, este fue un objetivo secundario y el trabajo estaba potenciado para predecir factores de riesgo asociados independientemente al éxito o falla de extubación. Cabe destacar que todos los pacientes con falla en el destete tenían una Ptr,Stim por debajo del punto de corte que usaron para diagnosticar DD, aunque algunos pacientes del grupo de destete exitoso también. Además hay que tener en cuenta que todos los pacientes debían tener diagnóstico de DAUCI previo al ingreso al estudio.
Lu et al 24 observó que los pacientes con DD tenían mayor duración de VMI luego de la inclusión, mayor estadía en UCI y mayor mortalidad hospitalaria. A su vez encontró una tendencia a una mayor estadía hospitalaria, aunque sin significancia estadística.
Dubé et al 19 encontró que los pacientes con DD presentaron mayor estadía en UCI, más días de VMI y de VMI después de la medición, así como también mayor mortalidad tanto en UCI como hospitalaria. A su vez hicieron hincapié en el cuidado de la generalización de los resultados, producto que el estudio, si bien tenía una gran muestra, fue realizado sólo en una UCI médica.
Huang et al 4 encontró que los pacientes con DD tenían mayor falla de destete, mayor tiempo de destete y mayor tiempo total de VMI. Encontró también una tendencia a mayor estadía tanto en UCI como en el hospital (aunque sin diferencia estadísticamente significativa) en el grupo con DD y no encontró diferencia con respecto a la mortalidad a 28 días. Sin embargo, como limitación nombra que la muestra era pequeña y que no hay punto de corte establecido para EXdi en pacientes mayores por lo que la elección tal vez no fuera la ideal. Sumado a esto el estudio no estaba potenciado para esta variable en cuestión.
Grosu et al 3 encontró que los pacientes desarrollaban adelgazamiento del diafragma a las 72 de VMI y que llamativamente estos presentaban menor tasa de falla de extubación. Sin embargo, la muestra era pequeña y el estudio no estaba potenciado para valorar la correlación entre el adelgazamiento y la fuerza del diafragma. Con respecto a la herramienta de evaluación, no parecería ser la correcta para valorar la fuerza diafragmática, lo cual se vio en el trabajo de Dubé et al 19 , donde no se observó correlación entre Tdi y el patrón de oro. Por todos estos motivos concluyen que no pueden encontrar una correlación con la falla de extubación.
Dres et al 23 encontró que los pacientes con DD eran más grandes, tenían más días de VMI previo a la inclusión en el estudio que los pacientes sin DD. Además, encontró que la DD estaba asociada de manera independiente con la falla de destete. También informó que aquellos pacientes que tenían DD presentaban mayor mortalidad tanto en UCI, como en el hospital, mayor porcentaje de destete dificultoso y prolongado, así como también mayor duración de VMI y más días de estadía en UCI.
Goligher et al 29 encontró que el desarrollo de atrofia diafragmática generaba mayor duración de VMI, mayor estadía en UCI y en el hospital, así como también mayores complicaciones, tasa de re-intubación y TQT que en el subgrupo que no desarrolla atrofia.
La mayoría de los trabajos encontraron que los pacientes con DD presentaban mayor mortalidad en UCI con diferencias estadísticamente significativas con respecto a los pacientes que no tenían DD 9 , 19 , 23 , 25 , 27 , 28 . Lo mismo sucede con la mortalidad hospitalaria, donde la mayoría de los trabajos encontraron diferencias significativas entre los subgrupos con y sin DD 19 , 23 , 24 , 27 . Goligher et al 29 por su parte, encontró una tendencia a mayor mortalidad tanto en UCI como en el hospital en los pacientes con DD.
Destete y re-intubación
Con respecto al destete, la mayoría de los trabajos encontraron mayor falla en el subgrupo con DD 4 , 13 , 23 , así como también mayor tiempo 4 , 9 , 13 y mayor porcentaje de destete dificultoso y prolongado 23 . Por último, Goligher et al 29 informó mayor tasa de re-intubación en los pacientes con DD, también con diferencia estadísticamente significativa.
Estadía en UCI y hospitalaria
La mayoría de los estudios encontraron mayor estadía en UCI en los pacientes con DD 4 , 13 , 19 , 23–25 , 28 , 29 , aunque sin diferencias estadisticamente significativas en tres de ellos 4 , 25 , 28 . Goligher et al 29 y Kim et al 13 encontraron que los pacientes con DD presentaban también mayor estadía hospitalaria, Dres et al 23 , Lu et al 24 y Huang et al 4 solo una tendencia a este resultado y Demoule et al en sus dos cohortes no encontró diferencias entre los pacientes con DD y aquellos sin DD 27 , 28 .
Duración de VMI
La mayoría de los estudios encontraron mayor duración de VMI en los pacientes con DD 4 , 9 , 13 , 19 , 23 , 24 , 29 , con diferencias estadísticamente significativas en relación a los pacientes sin DD, mientras que Mariani et al 25 y Demoule et al 28 solo encontraron una tendencia a mayor duración de VMI en este subgrupo de pacientes.
Tasa de traqueostomía
Solo dos trabajos informaron esta variable 27 , 29 . Demoule et al 27 no encontró diferencia entre los pacientes con DD y sin DD, mientras que Goligher et al 29 encontró que la DD se asociaba de manera independiente con mayor tasa de TQT.
Conclusión
La DDIVM es una entidad de reciente definición y de interés creciente, evidenciado por la gran cantidad de publicaciones relacionadas con el tema. Sin embargo, existe amplia variabilidad en los puntos de corte para determinar la alteración y los métodos diagnósticos utilizados. Esto impacta directamente en los resultados que los trabajos informan.
En 2004, se establece inicialmente su definición, la cual es fisiopatológica. Esto podría ser uno de los orígenes de la variabilidad posterior, debido a que la falta de especificidad que conlleva este tipo de definiciones, impide lograr un consenso entre los distintos autores. Inicialmente vemos el impacto a la hora de analizar los criterios de inclusión de los estudios, donde se observa que el tiempo de VMI previo a la inclusión de los participantes es ampliamente variable. Los métodos diagnósticos, no son ajenos a este problema, y esto queda claro al ver los diferentes métodos utilizados, independientemente de la existencia de un patrón de oro. La justificación radica en la dificultad tanto para la implementación clínica inicial del patrón de oro, así como también para el seguimiento posterior. Sin embargo son pocos los estudios que realizan análisis de correlación de los métodos diagnósticos alternativos, aunque son varios los que lo utilizan. Con respecto a los puntos de corte seleccionados para determinar la presencia de la alteración, también es variable entre los distintos trabajos. Estos son los motivos que podrían explicar el amplio rango de prevalencia reportado por los diferentes autores, que también va a influir en las variables de resultado.
A pesar de la consistencia entre estudios respecto de la relación entre DD y la mayoría de las variables de resultado, cabe destacar que varios de estos estudios no fueron diseñados ni potenciados para hallar estas diferencias, por lo que se requieren de más estudios específicamente diseñados para tal objetivo, considerando las posibles variables de confusión que puedan presentarse. Esta imposibilidad de los estudios de encontrar asociación independiente, es lo que probablemente genere que se hable de disfunción diafragmática y no de disfunción diafragmática inducida por la ventilación mecánica.
Agradecimientos:
Licenciada Kinesióloga Fisiatra Eliana Perez Calvo.
Licenciado Kinesiólogo Fisiatra Sacha Alexis Virgilio.
Limitaciones de responsabilidad: La responsabilidad del trabajo es solo de los autores.
Fuentes de apoyo: No posee.
Originalidad: Este artículo es original y no ha sido enviado para su publicación a otro medio de difusión científica en forma completa ni parcialmente.
Cesión de derechos: Los participantes de este trabajo ceden el derecho de autor a la Universidad Nacional de Córdoba para publicar en la Revista de la Facultad de Ciencias Médicas y realizar las traducciones necesarias al idioma inglés.
Conflicto de interés: No se reporta conflicto de intereses.
Participación de los autores: Todos los autores han participado en la idea y redacción del proyecto, procesamiento de la información y elaboración del manuscrito, haciéndose públicamente responsables de su contenido y aprobando su versión final
Bibliografía

- He olvidado mi contraseña
- Contacte con nosotros

Medicina Intensiva es la revista de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias y se ha convertido en la publicación de referencia en castellano de la especialidad. Desde el año 2006 está incluida en la base de datos de Medline. Cada número es distribuido entre profesionales relacionados con la Medicina Intensiva, y llega a todos los miembros de la SEMICYUC. Medicina Intensiva publica principalmente artículos Originales, Revisiones, Notas clínicas, Imágenes en Medicina Intensiva e Información relevante de la especialidad. Cuenta con un prestigioso Consejo de Redacción y con importantes especialistas de renombre en el ámbito mundial. Todos los trabajos pasan por un riguroso proceso de selección, lo que proporciona una alta calidad de contenidos y convierte a la revista en la publicación preferida por el especialista en Medicina Intensiva, Crítica y Unidades Coronarias.
Indexada en:
Index Medicus / MEDLINE / EMBASE / Excerpta Medica / SCOPUS / MEDES / Science Citation Index Expanded, Journal of Citation Reports
Síguenos:
Suscribirse:.

El factor de impacto mide la media del número de citaciones recibidas en un año por trabajos publicados en la publicación durante los dos años anteriores. © Clarivate Analytics, Journal Citation Reports 2022
CiteScore mide la media de citaciones recibidas por artículo publicado.
SJR es una prestigiosa métrica basada en la idea de que todas las citaciones no son iguales. SJR usa un algoritmo similar al page rank de Google; es una medida cuantitativa y cualitativa al impacto de una publicación.
SNIP permite comparar el impacto de revistas de diferentes campos temáticos, corrigiendo las diferencias en la probabilidad de ser citado que existe entre revistas de distintas materias.
- Palabras clave
- Introducción
- Aportaciones de la ecografía torácica al paciente crítico
- Limitaciones de la ecografía torácica
- Sistemática de la exploración pulmonar
- Principios físicos básicos de la ecografía torácica
- Patrones ecográficos
- Patrón intersticial
- Afectación pleural
- Condensaciones subpleurales
- Patrón de consolidación alveolar o hepatización pulmonar
- Signos ecográficos relacionados
- Ecografía, neumotórax y covid-19
- Signos ecográficos relacionados con el derrame pleural
- Clasificación del líquido pleural
- Cuantificación del derrame pleural
- Desplazamiento o excursión
- Grosor diafragmático y fracción de engrosamiento diafragmático o thickening fraction
- Conclusiones
- Contribución de los autores
- Conflicto de intereses
- Bibliografía
Editado por: Ana Ochagavía - Hospital Universitario de Bellvitge. L'Hospitalet de Llobregat. Barcelona. Spain.
La utilidad de la ultrasonografía para la exploración del tórax fue descrita en 1968. No es hasta la década de los 90 cuando se generaliza su uso en las unidades de cuidados intensivos como una herramienta diagnóstica, de seguimiento y guía en procedimientos invasivos. Que sea una herramienta no invasiva, accesible a pie de cama, con una sensibilidad y especificidad cercanas a la tomografía computarizada (TC) y con una curva de aprendizaje corta, la ha convertido en una técnica de uso obligado en el manejo del paciente crítico.
Es fundamental conocer que la distinta relación aire/fluido que generan las distintas patologías pulmonares da lugar a distintos patrones ecográficos. La identificación de estos patrones junto con la información clínica nos permitirá hacer un diagnóstico acertado en la mayor parte de causas de insuficiencia respiratoria.
Asimismo, no debemos olvidar la importancia de la evaluación de la función diafragmática mediante ecografía durante la desconexión de la ventilación mecánica.
The usefulness of ultrasound for chest exploration was described in 1968. It was not until the 1990s, when its use became widespread in Intensive Care Units as a diagnostic, monitoring and procedural guide tool. The fact that it is a non-invasive tool, accessible at the bedside, with a sensitivity and specificity close to computerized tomography (CT) and with a short learning curve, have made it a mandatory technique in the management of critically ill patients.
It is essential to know that there are different air/fluid ratio generated by different pathologies that gives rise to one echographic pattern or another. The identification of these patterns together with the clinical information will allow to make an accurate diagnosis in most settings of respiratory failure.
Likewise, we must not forget the importance of evaluating diaphragmatic function by ultrasound during weaning from mechanical ventilation.
El uso de la ecografía para la exploración del tórax fue descrito por primera vez por Ross et al. en 1968. Sin embargo, no fue hasta los años 90 cuando el profesor Lichtenstein demostró que el dogma clásico de que el pulmón no era un órgano explorable mediante ultrasonografía era falso. En las últimas dos décadas la ecografía torácica y diafragmática se han convertido en una herramienta diagnóstica, de monitorización y guía de procedimientos invasivos indispensable en cualquier unidad de cuidados intensivos (UCI).
En el presente capítulo nos centraremos en explicar los fundamentos y peculiaridades de esta técnica, describir los patrones fundamentales que nos permitirán realizar un diagnóstico correcto de las causas más frecuentes de insuficiencia respiratoria aguda (IRA) y dedicaremos una sección específica para introducir la sistemática y parámetros más empleados para la evaluación de la función diafragmática mediante ecografía.
La ecografía es una técnica que ha incrementado su empleo progresivamente en las UCI. La información obtenida mediante las diferentes modalidades de ultrasonografía puede ser interpretada e integrada en la valoración global, durante la exploración del paciente.
Ausencia de emisión de radiaciones: tradicionalmente el abordaje diagnóstico del tórax en el paciente crítico se ha basado en la radiografía simple y debido al elevado número de pruebas no es desdeñable la radiación evitable 1 .
Portabilidad a la cabecera del paciente: supone minimizar los riesgos de traslados, evitando riesgos de exposición al personal sanitario.
Permite repetir la prueba tantas veces como sea necesaria, su grabación y comparación temporal 1 .
Superior a la radiología simple para detectar neumotórax, DP, neumonía, síndrome alveolo-intersticial (SAI) y en el diagnóstico diferencial de la disnea aguda. La evaluación de los pacientes con IRA a través del protocolo BLUE ( Bedside Lung Ultrasound in Emergency ) es una de las aplicaciones conocidas y consolidadas de la ecografía pulmonar 2 .
En los procedimientos invasivos, ha demostrado aumentar su seguridad.
Los dispositivos portátiles son más fáciles de esterilizar por presentar áreas de superficie más pequeñas que otros dispositivos radiológicos 3 .
Su aprendizaje exige un proceso estructurado de formación, por lo que la interpretación es dependiente de la experiencia y formación del médico que realiza la exploración.
La clínica es el factor determinante que ayuda a interpretar los datos obtenidos mediante ecografía torácica (signos poco específicos pero muy sensibles).
El ecógrafo y el transductor pueden ser un reservorio de gérmenes y ser una fuente de contaminación.
Es una técnica de imagen de superficie. Si el proceso patológico no alcanza la pleura, no se visualizará la patología subyacente.
La elección de la sonda de exploración ecográfica es el punto más importante para una correcta evaluación ecográfica pulmonar. Debido al conflicto existente entre resolución y penetración, es importante escoger la sonda adecuada a la patología que se desee explorar. En la valoración de patología pleural es fundamental una sonda de alta resolución con rango de emisión en torno a los 7-10 MHz. Esta sonda alcanza una profundidad de exploración próxima a los 6 cm de profundidad. Para el estudio de la patología pulmonar se necesita una profundidad de exploración de aproximadamente 25-30 cm, que se consigue con sondas cuyo rango de frecuencia está en torno a los 3,5-5 MHz 1 .
Exploración bidimensional del cuadrante: colocando el transductor en sentido perpendicular a las costillas y centrado en un espacio intercostal.
Una vez obtenida la imagen bidimensional se realiza el estudio en modo M, fundamental en el diagnóstico del pulmón normal, el neumotórax y el DP.
Estudio con Doppler color: siempre que aparezca un patrón de consolidación pulmonar subpleural, permitiendo la identificación de la circulación pulmonar.
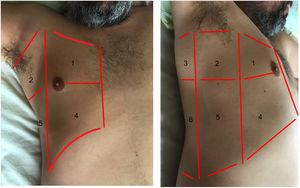
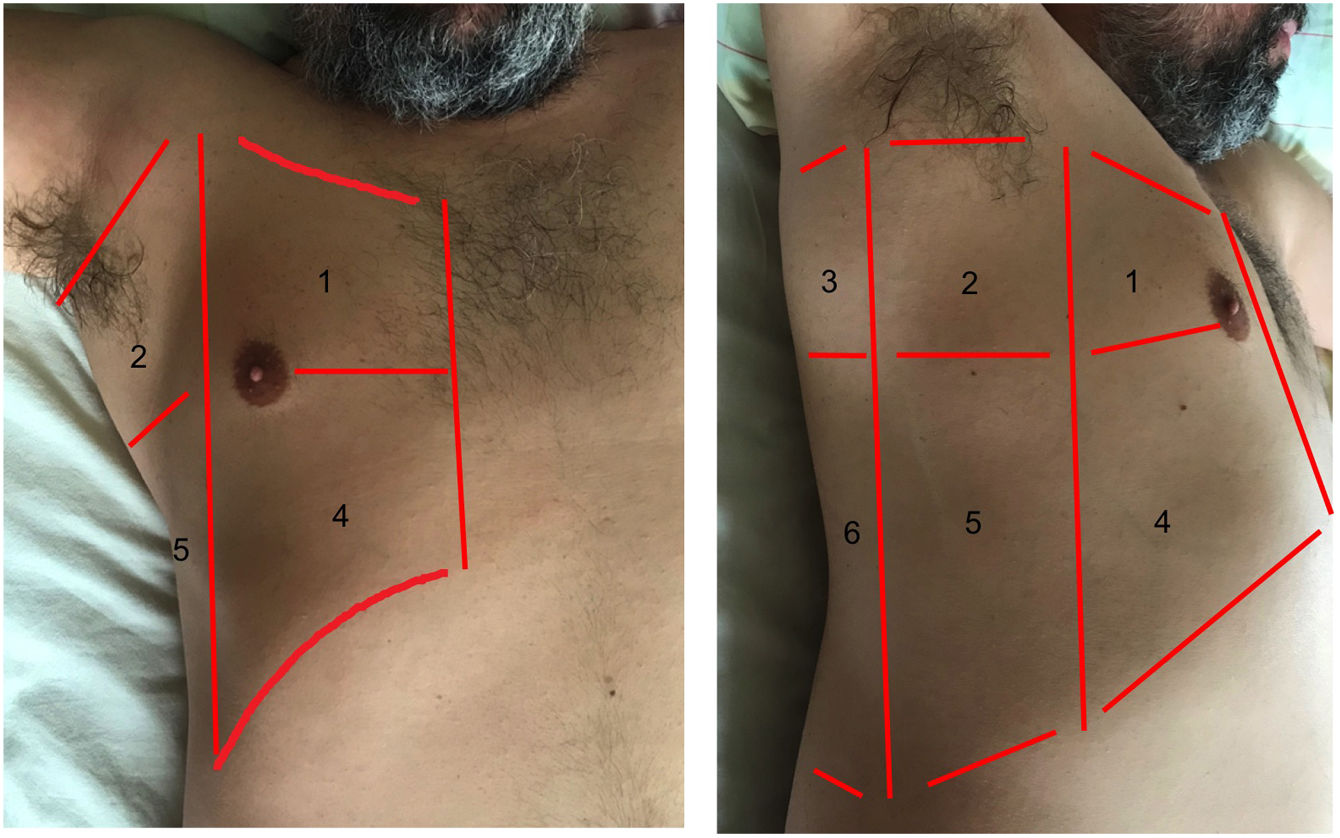
Áreas para la exploración ecográfica del tórax.
El área anterior comprende el espacio delimitado entre el esternón (medial), la línea axilar anterior (lateral), la clavícula (craneal) y el diafragma (caudal). El área lateral comprende el espacio delimitado por la línea axilar anterior (medial), línea axilar posterior (lateral), axila (craneal) y diafragma (caudal). El área posterior comprende el espacio delimitado por la línea axilar posterior (lateral), línea paravertebral (medial), borde del trapecio (craneal) y diafragma (caudal). Cada una de ellas puede subdividirse en una zona superior y otra inferior dando como resultado 6 áreas ecográficas de exploración.
El aire no conduce los ultrasonidos.
Todos los signos/artefactos parten de la línea pleural.
Relación aire / líquido.
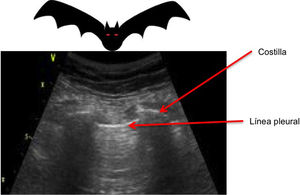
«Signo del murciélago» o bat sing .
«Signo del murciélago», se denomina así a la imagen formada por la línea pleural entre la sombra acústica que generan dos costillas consecutivas cuando colocamos nuestro transductor en posición longitudinal.
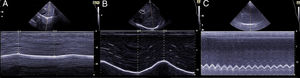
Los distintos patrones ecográficos reflejan una distinta relación aire / líquido ( fig. 3 ) 5 .
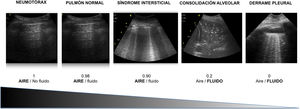
Ratio aire/fluido según las distintas patologías.
Patrón A: se caracteriza por la presencia de sliding ( vídeo 1 ) y el artefacto que lo define son las líneas A ( fig. 4 ) 5,7 . Si exploramos en modo M, aparece el «signo de la orilla» o seashore sign ( Supl. fig. 2 ) 5 .
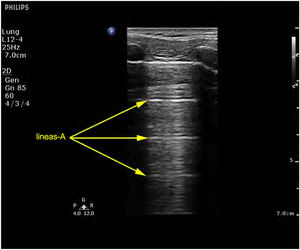
Patrón de líneas A, artefactos hiperecogénicos horizontales que no son más que la repetición de la línea pleural.
Patrón A’: muestra ausencia de sliding y presencia de líneas A ( vídeo 2 ). Este patrón sugiere la existencia de neumotórax. Confirma la presencia de neumotórax el hallazgo del denominado «punto pulmón» o lung point , punto en que las dos pleuras vuelven a deslizarse la una sobre la otra en un neumotórax no masivo ( vídeo 3 ) 6 .
Patrón B: la ocupación del intersticio pulmonar por líquido, productos inflamatorios o material fibrótico da lugar a la existencia de dos regiones con una impedancia acústica distinta, mostrando el artefacto característico de este patrón, las líneas B ( vídeo 4 ) 6 . Para poder hablar de un patrón B tenemos que evidenciar 3 o más líneas B entre dos costillas, en 2 o más regiones y separadas por 7 mm o menos.
Patrón B’: similar al B, con ausencia de sliding . Aparece en patologías como el síndrome de distrés respiratorio agudo (SDRA), neumonías y fibrosis pulmonar, en las cuales se producen adherencias pleurales que condicionan una disminución o ausencia del sliding , así como engrosamiento pleural o aparición de anomalías pleurales ( vídeo 5 ). Es característico que la afectación pulmonar sea heterogénea y que en el mismo paciente ocurran distintos patrones ecográficos 8 .
Patrón C: muestra el tissue-like sign o el shred sign. En el tissue-like sign : el parénquima pulmonar consolidado tiene una ecogenicidad similar a la del hígado. Dentro de la consolidación podemos evidenciar imágenes hiperecogénicas correspondientes a broncograma aéreo ( fig. 5 ). El shred sign consiste en consolidaciones de menor tamaño, que aparecen como una disrupción en la línea pleural, de borde irregular o aserrado que separa la consolidación del pulmón aireado ( fig. 6 ) ( vídeo 6 ) 5 .
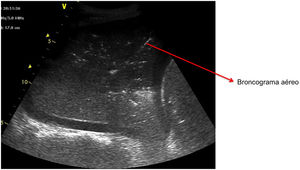
Patrón de consolidación.
Imagen con un patrón de consolidación alveolar con broncograma aéreo.
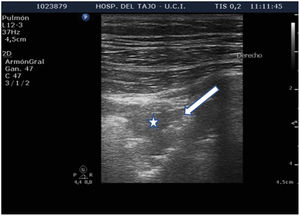
Sherd sign .
Imagen de condensación subpleural (estrella). Presenta una zona central hipoecoica, rodeada de un margen hiperecoico mal definido, en contacto con la pleura (flecha).
La relación entre el contenido de gas y de líquidos determina las imágenes que encontramos en la ecografía pulmonar ( fig. 3 ), imágenes que se modifican rápidamente con la evolución del paciente. De este modo, el SAI explorado mediante ultrasonidos muestra diferentes patrones que apuntan hacia distintas causas.
Se caracteriza por la presencia de múltiples líneas B, de distinto grosor y de forma simétrica o asimétrica en el tórax. Puede indicar tanto edema pulmonar cardiogénico como cualquier proceso inflamatorio con infiltrado intersticio-alveolar. Para entender la causa de este patrón es necesario explorar también la función cardiaca y la precarga.
El patrón intersticial incluye los siguientes hallazgos: abundantes líneas B bilaterales o unilaterales dependiendo de la etiología, posible aparición de zonas de condensación y posible presencia de DP.
En el SAI se encuentran líneas B proporcionales al grado de afectación pulmonar. La presencia de líneas B separadas con una distancia inferior a 3 mm se asocia a edema alveolar, correspondiéndose con el patrón en vidrio deslustrado que observamos en la TC 6,9–11 . El número de líneas B en cada área explorada se correlaciona con el contenido líquido 11–16 ( Supl. fig. 3 ).
El SAI aparece en enfermedades crónicas (fibrosis pulmonar) o agudas (edema pulmonar agudo cardiogénico, SDRA, neumonía) que cursan con depósito en el intersticio de tejido proliferativo o líquido. La aparición de abundantes líneas B en ambos hemitórax de forma difusa favorece el diagnóstico de edema pulmonar cardiogénico o SDRA; su existencia unilateral hace pensar en procesos neumónicos o inflamatorios locales ( Supl. fig. 4 ).
En el SAI existen con frecuencia procesos inflamatorios que afectan a la pleura. En este caso, la ecografía muestra engrosamiento e irregularidad de la línea pleural, a diferencia de una pleura muy fina y homogénea en el pulmón normal o en el caso del SAI secundario a un edema pulmonar cardiogénico ( Supl. fig. 5 ).
Los cambios inflamatorios que afectan a la pleura y al pulmón se reflejan también en una disminución del deslizamiento pleural normal, especialmente si existe, además, una disminución de la ventilación de la zona explorada. Este hallazgo obliga a excluir la existencia de una atelectasia en la misma región. La ausencia completa del deslizamiento pleural ocurre en la atelectasia, la hepatización completa, el neumotórax y la ausencia de ventilación en el pulmón explorado en el paciente intubado.
La presencia de una línea pleural fragmentada (irregular o discontinua) explorada en modo M se muestra a favor de que el SAI se deba a una causa no cardiogénica 17,18 .
Las condensaciones subpleurales aparecen como zonas hipoecoicas, con bordes mal definidos, en contacto con la pleura ( fig. 6 ), que no suelen superar 1-2 cm de diámetro máximo. Se encuentran generalmente en las zonas anteriores del tórax en pacientes en decúbito supino y se corresponden con fenómenos inflamatorios pulmonares.
La hepatización pulmonar se describe como la apariencia de tejido hepático que toma el pulmón consolidado en la ecografía. Esta imagen es apreciable con mayor facilidad en las consolidaciones supradiafragmáticas ( Supl. fig. 6 ).
Ante la sospecha de neumotórax, la ecografía cobra especial relevancia en situaciones clínicas, como traumatismos torácicos, barotrauma asociado a ventilación mecánica (VM), tras la canalización de accesos venosos centrales y en pacientes que se van a trasladar mediante transporte aéreo. Estas situaciones podemos encontrarlas en un área de pacientes críticos o en un servicio de urgencias, en donde deberemos disponer de un equipo de ecografía con sonda lineal preferentemente (7,5-12 MHz), para poder descartar la presencia de neumotórax.
Líneas A ( fig. 4 ): indican la presencia de aire en tórax. Es un hallazgo siempre presente al diagnosticar un neumotórax.
Ausencia de lung sliding: ante un neumotórax, desaparece el deslizamiento pleural ( vídeo 2 ) ya que el gas separa las pleuras. Este hallazgo no es patognomónico de neumotórax, encontrándose también en situaciones en las que el pulmón no esté siendo aireado (intubaciones selectivas y esofágicas o atelectasias). La presencia de deslizamiento pleural excluye el neumotórax con un valor predictivo negativo y una sensibilidad del 100% 2 . Cuando se combinan la presencia de líneas A y la ausencia de sliding se alcanza una sensibilidad del 100% y una especificidad del 96% 2
Líneas B: la presencia de al menos una línea B descarta este diagnóstico.
Enfisema subcutáneo y líneas E: el aire que invade los tejidos blandos ante un neumotórax nos impide reconocer la línea pleural. Se identifican entonces las líneas E ( vídeo 7 ), líneas verticales originadas en capas superficiales que borran por completo la línea pleural, dificultándonos reconocer cualquier artefacto en el espacio de Merlín.
«Punto pulmón» o lung point: signo patognomónico de neumotórax. Representa el punto de disrupción pleural, es decir, donde se separan ambas hojas pleurales ( vídeo 8 ). En la imagen ecográfica dinámica, vemos el punto exacto donde el deslizamiento pleural conservado (en inspiración) coexiste con la ausencia de deslizamiento pleural (en espiración) y por ello, se localiza el punto exacto del desgarro pleural. La ausencia de detección del lung point no descarta completamente la presencia de neumotórax, ya que no existirá en el neumotórax masivo. Cuanto más lateral e inferior se localice este punto, mayor la extensión del neumotórax, siendo aún más mayor al ser muy posterior.
Signo del «código de barras» o de la «estratosfera»: representa en modo M la ausencia de deslizamiento pulmonar. Consiste en el hallazgo de múltiples líneas horizontales de diferente ecogenicidad ( vídeo 9 ).
Lung pulse o «pulso pulmón»: en ausencia de deslizamiento pleural, representa la transmisión del latido cardiaco sobre el pulmón colapsado o consolidado, excluyendo el neumotórax. En modo M viene representado por las líneas T descritas por Lichtenstein ( Supl. Figura 7 ), que son líneas verticales estrechas que parten en modo M de la línea pleural.
Ante dolor torácico o inestabilidad hemodinámica en un caso de infección por covid-19, la ecografía es una herramienta diagnóstica fundamental para el diagnóstico de embolismo pulmonar, DP o neumotórax.
Una línea pleural irregular, con consolidaciones subpleurales y abundantes líneas B de distribución parcheada, son hallazgos ecográficos típicos de la infección por covid-19. También, el «signo del haz de luz» o light beam , descrito por Volpicelli et al., presente en la fase hiperaguda de la neumonía como artefactos verticales en forma de bandas caracterizadas por ser luminosas, anchas, moverse rápidamente con el lung sliding y que presentan fenómeno de on/off durante la respiración, apareciendo y desapareciendo sobre un patrón de líneas A 20 .
La ecografía valora el volumen (detecta milimétricas cantidades) y las características de un DP, permitiendo orientar el lugar de punción para su evacuación cuando se precisa. Para ello, la sonda ideal será de baja frecuencia como la sonda cónvex (2,5-5 Hz) que, sacrificando su capacidad de resolución, permite una mayor penetración de las ondas de ultrasonido para alcanzar mayor profundidad y poder visualizar diafragma e hígado o bazo, y su relación con el parénquima pulmonar.
Con el paciente en decúbito supino posicionaremos el transductor en la línea axilar media e iremos a localizar la referencia fundamental del estudio: el diafragma. Toda imagen anecoica localizada por encima del diafragma pertenece a la cavidad torácica (líquido pleural); en cambio, si este hallazgo se encuentra por debajo del diafragma, corresponderá a la cavidad abdominal (líquido ascítico) ( vídeo 10 ).
El DP es una imagen real, no un artefacto. Clásicamente se definió como una imagen anecogénica. El aspecto de estas efusiones en los pacientes críticos no siempre es así, puesto que pueden coexistir hemotórax, derrames complicados y empiemas, mostrando distintos grados de ecogenicidad.
Signo del límite regular o quad sign ( Supl. fig. 8 ): es un signo estático, definido por un cuadrilátero de bordes regulares. El borde superior está formado por la pleura parietal, el inferior por la pleura visceral, y los laterales por las sombras de dos costillas consecutivas.
Signo del sinusoide ( Supl. fig. 8 ) ( vídeo 11 ): es un signo dinámico. Representa en modo M la forma de un sinusoide como reflejo de la variación de la distancia interpleural con los movimientos respiratorios. De esta forma, en inspiración la distancia es menor y en espiración ambas pleuras están más separadas. Cuando el líquido es más viscoso o está tabicado, este signo puede estar ausente.
Signo de la medusa o de la cola de sirena: cuando hay líquido intrapleural significativo, el pulmón subyacente se colapsa, mostrando en su parénquima broncograma aéreo estático. Este pulmón atelectasiado flota dentro del DP significativo, y su parte más inferior se aprecia danzando libremente dentro de este líquido recordando el movimiento de una especie de alga ( vídeo 12 ).
Hasta el momento actual, no hay ningún signo ecográfico que con certeza apoye la diferenciación entre trasudado y exudado. Lo que sí podemos interpretar es el aspecto del líquido. Podemos encontrar DP simple (generalmente anecoico), DP complejo tabicado o no tabicado (generalmente corresponde a exudados) ( vídeo 13 ) y líquido ecogénico difuso (que se asocia frecuentemente a la presencia de fibrina o proteínas). El signo del plancton ( vídeo 14 ) consiste en la presencia de un punteado ecogénico flotando libremente en el DP. Aunque puede hacer sospechar que nos encontramos ante un DP complicado, no permite de forma rigurosa y certera esta diferenciación.
La valoración del DP se puede realizar de forma cualitativa o cuantitativa. La estimación cualitativa permite la clasificación en derrame mínimo, moderado o severo, mientras que la aproximación cuantitativa requiere del empleo de fórmulas.
La realización de una punción torácica tiene riesgos y por ello se debiera encontrar una fórmula simple, rápida y rigurosa que oriente a esta necesidad. Por su simplicidad, una de las más utilizadas es la que propuso Balik 21 . Se realiza en decúbito supino, a 15° aproximadamente, y en espiración se toma en cuenta el diámetro mayor en el espacio interpleural en milímetros. Este valor obtenido se multiplica por 20 y obtenemos la cantidad de mililitros aproximados. Esta fórmula se encuentra validada en VM.
El diafragma es el principal músculo respiratorio y consta de dos hemidiafragmas, con una doble inervación. Su contracción producirá un desplazamiento caudal que aumenta el volumen de la caja torácica y genera una presión negativa en respiración espontánea. Existen numerosas situaciones que favorecen la aparición de disfunciones en este músculo y que pueden complicar de forma considerable el destete de la VM. La disfunción diafragmática resulta de problemas anatómicos, neuromusculares o biomecánicos que alteran su contracción. Patologías torácicas y abdominales (atelectasias, cirugías, etc.) y afecciones neurológicas centrales o periféricas reducirán la movilidad del diafragma. Esta disfunción condicionará el ingreso hospitalario, el uso de VM o su prolongación y/o el fallo en la extubación.
En los últimos años se ha incrementado e implementado el uso de la ecografía diafragmática, ya que permite evaluar de forma bilateral tanto la morfología y la función diafragmática en tiempo real como el seguimiento funcional 22–25 .
La observación de la cinética del diafragma en los pacientes en UCI es esencial para diagnosticar de manera temprana y eficaz la parálisis diafragmática, la disfunción diafragmática postoperatoria y el momento ideal para la retirada de la VM 22–29 . Se han propuesto varios métodos para evaluar la función diafragmática, siendo fundamentalmente dos: el desplazamiento o excursión de la cúpula y el grosor diafragmático con la fracción de engrosamiento ( vídeo 15 ) 22,26,30,31 .
La medición del desplazamiento evalúa la capacidad del diafragma de generar cambios de volumen en la caja torácica 29,31 . Se coloca al paciente en decúbito supino, con el tronco elevado 30°, buscando el hemidiafragma de estudio en modo 2D. Para ello, se procede a un abordaje subcostal usando una sonda convexa de baja frecuencia a nivel de la línea medio clavicular, buscando el tercio posterior de la cúpula diafragmática en el lado derecho, a través de la ventana hepática (posicionaremos el cabezal del ecógrafo entre las líneas medio-clavicular y antero-axilar y la dirigiremos hacia medial, craneal y dorsal para que el haz alcance el tercio posterior del diafragma) ( Supl. fig. 9 ) 22,26,28,30 . En el lado izquierdo se utiliza la ventana esplénica, pero la cúpula es más difícil de localizar, generalmente por interposición de vísceras abdominales ( Supl. fig. 10 ). Para obtener la mejor imagen se colocará la sonda en la zona subcostal o intercostal inferior entre las líneas medio-axilares y anterior o a nivel medio-clavicular. La sonda se dirigirá de manera similar que en el lado derecho para visionar también el tercio posterior. Una alternativa es el abordaje lateral, colocando la sonda en posición perpendicular en los espacios intercostales inferiores a nivel de la línea medio axilar ( Supl. fig. 10 ) 22 .
Tras la localización de la cúpula en modo 2D, el modo ecográfico M facilita la identificación de la porción de la cúpula con mayor movilidad, para su medición en un corte sagital. En ambos lados observaremos una línea curva e hiperecogénica que corresponderá al diafragma ( Supl. fig. 11 ). Observaremos una curva correspondiente al ciclo respiratorio en el que la parte superior corresponde al tiempo inspiratorio (durante la inspiración, el movimiento del diafragma es caudal y la línea se acercará hacia el transductor) y la parte inferior al tiempo espiratorio (el desplazamiento es craneal y la línea se alejará del transductor) ( Supl. fig. 11 ) 30–32 .
Por lo general, se interpretan ciclos respiratorios correspondientes a respiraciones lentas y profundas en pacientes en respiración espontánea aunque también se puede medir durante esfuerzos de olfateo nasal o sniffing (poco utilizado en UCI). Podemos decir de una manera práctica que se mide el desplazamiento en respiración en reposo ( Supl. fig. 13 ) y en inspiración y espiración profundas ( Supl. figs. 11 y 12 ).
Dibujamos una línea vertical con el primer calibrador en la base de la curva inspiratoria que se corresponde con el final de la espiración normal, y en el segundo calibrador se fija en el pico de la curva inspiratoria. Tomamos como valor la media de las mediciones de 3 o más ciclos o el valor más elevado de 5 ciclos.
Existen diversos estudios que han evaluado la excursión en voluntarios sanos, siendo sus valores los referenciados en la Supl. tabla 2 27,31,32 .
La medición del grosor diafragmático es otro método empleado que permite determinar la masa muscular diafragmática y valorar la fracción de engrosamiento, o thickening fraction (TF) 27,30–32,38 .
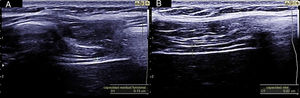
Para esta medición se utiliza una sonda lineal de alta frecuencia, colocada entre los últimos espacios intercostales (colocamos la sonda en la línea axilar anterior perpendicular, por lo general a los espacios intercostales 7°-8°, 8°-9°, y 9°-10° comprendiendo el transductor 2 costillas para visualizar la zona de aposición del diafragma ( Supl. fig. 13 ) con el paciente en supino idealmente. Se ha descrito también una localización de la sonda algo más posterior, entre las líneas axilares anterior y media. De esta forma se localiza la «zona de aposición», donde el diafragma se inserta en la pared costal. El diafragma se identifica como la franja hipoecoica limitada por dos líneas hiperecoicas, que corresponden a la pleura y al peritoneo ( Supl. fig. 14 ) 22,31–35 .
La medición del grosor diafragmático se realizará al final de la espiración no forzada. Se recomienda capturar al menos 3 imágenes para su cálculo. Existe una variabilidad entre las cifras de normalidad entre los diferentes estudios 35 . Tras el estudio de una muestra de 109 sujetos sanos, se publicaron unas cifras de normalidad de 0,16 ± 0,04 cm, con un valor medio para mujeres de 0,14 ± 0,03 cm y de 0,19 ± 0,04 cm para hombres ( Supl. fig. 15 ) 36 .
A diferencia del grosor, la variación del grosor diafragmático durante la inspiración supone una aproximación indirecta a la actividad del diafragma. Las fibras musculares se acortan durante la contracción y causan el aumento en el grosor muscular. Este aumento durante la inspiración ha sido utilizado como una medida indirecta de la capacidad de contracción.
El TF es la relación entre el grosor en reposo y en máxima inspiración. Mide el porcentaje de aumento del grosor del diafragma durante la inspiración máxima respecto a su grosor al final de una espiración no forzada ( Supl. fig. 16 ) 30–32 . Se recomiendan al menos 3 mediciones para el cálculo de este parámetro al final de la inspiración máxima y al final de una espiración no forzada o de reposo, y se realiza una media de ambas para el cálculo de la fracción de acortamiento ( Supl. fig. 16 ) utilizando la formula siguiente: 30–32,34–37 .
TF = grosor al final de la inspiración – grosor al final de la espiración / grosor al final de la espiración.
Se acepta como normal en personas sanas un TF mayor del 20-30%. La ausencia de cambio en el grosor durante la inspiración se ha considerado un método sensible y específico para el diagnóstico de parálisis diafragmática 38 .
Una curva de aprendizaje proporcionada a su propósito, y una sensibilidad y especificidad próxima a la TC en distintas situaciones de IRA, han convertido a la ecografía toracopleural y diafragmática en una herramienta diagnóstica indispensable en el manejo del paciente crítico. Permite acotar el diagnóstico diferencial en situaciones críticas y una monitorización no invasiva inmediata y repetida de las actuaciones terapéuticas. Todo ello hace indispensable un conocimiento creciente de esta exploración y genera la necesidad de continuar evaluando sus posibilidades.
Los autores Diego Aníbal Rodríguez Serrano, Purificación Pérez Terán, Rafael Blancas y Marta Arroyo han participado por igual en la elaboración, redacción y revisión del presente artículo.
Los autores Diego Aníbal Rodríguez Serrano, Purificación Pérez Terán, Rafael Blancas y Marta Arroyo declaran no tener ningún conflicto de intereses para este artículo, no habiendo recibido financiación alguna en su elaboración y redacción.
- Suscríbase a la newsletter
- Enviar a un amigo
- Exportar referencia
- Estadísticas

- Guía para autores
- Envío de manuscritos
- Ética editorial
- Visual abstract

- Articles in press
- Número actual
- Todos los números
- Supl. y colecciones
- Opción Open Access
- Servicios de edición
- Alcance y objetivos
- Comité editorial
- Contratar publicidad
- Lo más leído
- Lo más citado
- Más populares
- Todas las métricas
- Descargar PDF

Evaluación ecográfica de la función diafragmática en el paciente crítico
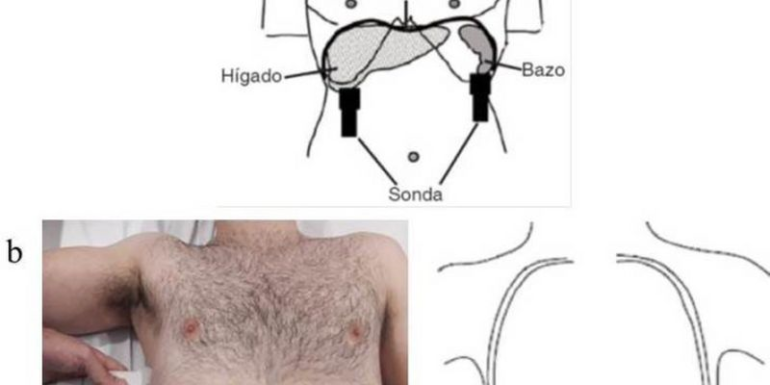
Charco Roca LM (1), Simón Polo E (2).
1 facultativo especialista de área servicio de anestesiología y reanimación, hospital general universitario de albacete., 2 médico interno residente servicio de anestesiología y reanimación, hospital general universitario de albacete..

Introducción
La ecografía en las unidades de cuidados críticos está imponiéndose en los últimos años como herramienta de diagnóstico rápido y monitorización en muy variadas patologías. Un mejor entendimiento de la fisiopatología del paciente crítico y la accesibilidad actual a los sistemas portátiles de ultrasonidos está revolucionando la exploración a pie de cama. La ecografía ha surgido como una técnica no invasiva que se puede utilizar en la evaluación estructural y funcional del diafragma. Los ultrasonidos permiten observar el movimiento diafragmático en una variedad de condiciones normales y patológicas; puede evaluar las características del movimiento diafragmático, como la amplitud, la fuerza y la velocidad de contracción, los patrones especiales de movimiento y los cambios en el grosor del diafragma durante la inspiración. Estos parámetros diafragmáticos ecográficos pueden proporcionar información valiosa en la evaluación y el seguimiento de pacientes con debilidad diafragmática o parálisis, y pueden ayudar potencialmente a comprender la disfunción pulmonar causante de una insuficiencia respiratoria. Las mediciones por ultrasonido del espesor del diafragma son factibles y altamente reproducibles. En volúmenes inspiratorios clínicamente relevantes, el engrosamiento del diafragma refleja la contracción muscular y no la inflación pasiva. Esta técnica puede emplearse confiablemente para controlar el espesor, la actividad y la función del diafragma durante la ventilación espontánea y mecánicamente asistida. Este artículo revisa a propósito de cuatro casos clínicos la técnica y las aplicaciones clínicas de la ecografía en la evaluación de la función diafragmática en pacientes con insuficiencia respiratoria ingresados en una unidad de cuidados intensivos por diversos motivos.
Descripción de casos clínicos
Caso 1: Parálisis diafragmática secundaria a lesión medular cervical. Varón de 65 años sin antecedentes médico-quirúrgicos relevantes, que ingresó en la unidad de cuidados intensivos con el diagnostico de politraumatizado tras caída accidental desde tres metros de altura. El paciente presentaba un traumatismo craneoencefálico leve, traumatismo facial y traumatismo de raquis con fractura-luxación de C6-C7 y fractura de la lámina izquierda y apófisis espinosa de C4. Se indicó una resonancia magnética cervical urgente que mostró la presencia de subluxación C6-C7, con protrusión discal y presencia de hematoma epidural anterior a la altura de C6. Las imágenes mostraban una mínima deformidad medular con pequeñas zonas parcheadas de mielopatía y con otra zona más marcada de mielopatía por detrás de C3-C4. Con los hallazgos radiológicos y el diagnostico de lesión medular incompleta ASIA C con la exploración clínica el paciente fue intervenido de forma urgente realizándose discectomía y fijación de cuerpos vertebrales C6-C7 con placa por vía cervical anterior. Tras la intervención se procedió a despertar al paciente observando adecuadas condiciones neurológicas y mostrando buena dinámica respiratoria y volúmenes pulmonares con ventilación mecánica en modo CPAP (+ 6 CmH2O). Como prueba de extubación se puso en tubo en T y realizamos ecografía en plano subcostal observando adecuada excursión diafragmática. Al considerar segura la extubación esta fue realizada. El paciente permaneció en observación clínica los minutos posteriores y empezó a observarse empleo de la musculatura intercostal y abdominal accesorias en los ciclos respiratorios, asimismo refería sensación disneica. No se observó desaturación en el monitor de pulsioximetría. En este momento se realizó una ecografía diafragmática en modo M que mostraba ausencia de movilidad diafragmática significativa bilateral observando una fracción de acortamiento diafragmática nula. La radiografía de tórax no mostraba hallazgos significativos dado que la paresia diafragmática era bilateral y la inspiración se realizaba a consta de esfuerzo de musculatura accesoria (figura 1). Con estos signos clínicos y conociendo que el paciente tenia lesión medular cervical alta se decidió realizar traqueotomía quirúrgica ante la previsión de agotamiento respiratorio del paciente dada la afectación de la función diafragmática de origen neuromuscular. El paciente posteriormente permaneció con soporte ventilatorio según sus necesidades y tras ser intervenido de las fracturas panfaciales fue derivado a un centro de referencia especializado en lesión medular aguda para continuación de cuidados.
Caso 2: Aquinesia diafragmática por denervación traumática. Varón de 53 años ingresado en la unidad de cuidados intensivos tras traumatismo por accidente de motocicleta. El balance lesional de ingreso fue de traumatismo craneoencefálico severo, traumatismo facial, traumatismo torácico derecho con rotura de aorta ascendente contenida, neumotórax, contusión pulmonar y fracturas costales múltiples, traumatismo locomotor con fractura de cuello femoral izquierdo, traumatismo de raquis con fractura de apófisis transversas derechas C7, D2, D4, y todas las lumbares y aumento espacio epidural posterior C2-C4 en relación con hematoma cervical. El paciente presentó disfunción multiorgánica y posterior evolución respiratoria tórpida, en las radiografías se observaba imagen de consolidación pulmonar (contusión / sobreinfección) y derrame pleural izquierdo persistente con elevación hemidiafragmática derecha (figura 1). Tras la estabilización de las múltiples disfunciones orgánicas se procedió a retirada de sedación y destete de la ventilación mecánica siendo este muy dificultoso. Procedimos a evaluar la función diafragmática derecha observando ausencia de excursión diafragmática y en modo M ausencia de contracción traducida en fracción de acortamiento nula (figura 2). Se solicitó un estudio neurofisiológico que concluyó que presentaba una plexopatía braquial derecha severa, global-difusa, con mayor probabilidad completa. Asimismo con técnica electromiográfica mediante guía ecográfica se apreció denervación severa del hemidiafragma derecho compatible con neuropatía frénica de gran severidad. El destete respiratorio de este paciente precisó de descensos progresivos muy lentos del soporte ventilatorio y mucho apoyo de fisioterapia respiratoria.
Caso 3: Disfunción de marcapasos diafragmático. Varón de 63 años que a consecuencia de un traumatismo ingresó en la unidad de cuidados intensivos con los diagnósticos de traumatismo craneoencefálico leve, traumatismo facial y traumatismo vertebral con lesión medular a nivel de C2, ASIA A, con shock neurogénico, tetraplejia e insuficiencia respiratoria. Tras fijación quirúrgica de C2 a C5 y estabilización clínica fue traslado a un centro de referencia de manejo de lesionados medulares para continuación de cuidados. Por insuficiencia respiratoria de origen neuromuscular se le implanta marcapasos frénico que permite ventilación las 24 horas del día no precisando de ventilación invasiva domiciliaria. Tras tres meses del implante del marcapasos diafragmático acude a urgencias con signos de infección respiratoria y datos de insuficiencia respiratoria aguda hipercápnica. En la exploración radiológica se observa elevación marcada de hemidiafragma derecho (Figura 1). La exploración ecográfica permitió el diagnóstico rápido en el servicio de urgencias de ausencia de movilidad de hemidiafragma derecho que justifica el deterioro respiratorio del paciente. Tras ser diagnosticado de disfunción de marcapasos diafragmático es ingresado en la unidad de cuidados intensivos para soporte ventilatorio. Entre las complicaciones derivadas de estos dispositivos se incluye la posibilidad de fallo del marcapasos que se manifiesta con signos de insuficiencia respiratoria con necesidad de soporte ventilatorio y clínica de sobreinfección por mala movilización de secreciones. El paciente fue trasladado al centro de referencia de manejo de lesión medular para revisión y ajuste del dispositivo.
Caso 4: Paresia diafragmática unilateral tras hepatectomía derecha. Mujer de 72 años ingresada en la unidad de cuidados intensivos para vigilancia postoperatoria tras hepatectomía derecha por quiste simple recidivado. Entre sus antecedentes destacaban hipertensión arterial, exfumadora de 1 año previo, con bronquiectasias y varios ingresos por sobreinfecciones respiratorias y diagnosticada de probable obstrucción crónica al flujo aéreo. Fue intervenida de quiste hepático abscesificado hacía un año y ya entonces presentó un postoperatorio tórpido con insuficiencia respiratoria y necesidad de traqueotomía en la fase de destete de la ventilación mecánica. En el primer día de postoperatorio actual presenta insuficiencia respiratoria y en la radiografía de tórax de observa elevación diafragmática derecha con aire subfrénico y hemitórax derecho con patrón intersticial difuso, sin claros infiltrados (Figura 1). Realizamos ecografía diafragmática derecha en la que se muestra ausencia de contracción diafragmática y presencia de derrame pleural basal leve. La paciente realiza fisioterapia respiratoria intensiva y tras tres días se observó recuperación de la movilidad y contracción diafragmática explorada por ecografía. La sospecha diagnostica de la causa de disfunción diafragmática transitoria fue de paresia irritativa por contigüidad con el sitio quirúrgico.
El diafragma es el principal músculo respiratorio. La disfunción diafragmática puede ser causada por afecciones que afectan directamente al diafragma, como traumatismo, cirugía cardiotorácica, patología torácica o abdominal adyacente (p. Ej., Atelectasia pulmonar basal, neumonía o tumores), masas abdominales superiores, fluido pleural o abdominal extenso y distrofias musculares. El movimiento del diafragma también puede verse afectado por enfermedades del sistema nervioso central, lesión del nervio frénico en su trayecto en el cuello y el tórax, enfermedad de la neurona motora y enfermedades de la unión neuromuscular (1). La disfunción diafragmática tiene una alta incidencia en el paciente crítico y es una causa poco reconocida de insuficiencia respiratoria y destete prolongado de la ventilación mecánica. El motivo de que esta entidad se encuentre infradiagnosticada reside en su presentación variada y a menudo inespecífica. Los hallazgos clínicos incluyen disnea inexplicable, especialmente en posición supina, dificultad para destetar de la ventilación mecánica, elevación del diafragma en las radiografías de tórax, dificultad respiratoria inexplicable, patrón de respiración asimétrica, movimiento paradójico abdominal, neumonía recurrente o colapso pulmonar unilateral recurrente. El diagnóstico precoz de la disfunción diafragmática es importante, porque la parálisis diafragmática puede ser susceptible a estrategias terapéuticas y puede requerir un soporte ventilatorio adaptado y prolongado. Por lo tanto, la necesidad de evaluar la función del diafragma surge en muchas situaciones clínicas. En este artículo hemos expuesto diferentes casos que reflejan cuadros de insuficiencia respiratoria y complicaciones derivadas de mala función diafragmática con el fin de ilustrar la utilidad del uso de los ultrasonidos como método de diagnóstico de la disfunción diafragmática. Tradicionalmente, la evaluación de la función diafragmática se lleva a cabo a través de la historia, el examen físico, la prueba de aspiración fluoroscópica, los estudios de conducción nerviosa y la electromiografía (EMG). Los estudios de conducción nerviosa y EMG en este entorno son desafiantes, incómodos y pueden causar complicaciones graves, como neumotórax. Las pruebas de función pulmonar pueden ayudar a diagnosticar la debilidad del diafragma, pero su exactitud y reproducibilidad están limitadas por la dependencia del volumen pulmonar, el esfuerzo del paciente y el amplio rango de variabilidad dentro del rango normal (2). La ecografía neuromuscular es una técnica que ahora se utiliza para obtener imágenes del diafragma en condiciones normales y patológicas, dados los avances recientes que permiten imágenes de alta resolución. La ecografía es portátil, omnipresente en instalaciones médicas, no presenta riesgo de radiación ionizante y permite la visualización de estructuras debajo y encima del diafragma. Tiene la ventaja de evaluar los componentes estructurales y funcionales del diafragma en la cabecera del paciente. Se ha demostrado que la ecografía es similar en exactitud a la mayoría de las otras modalidades de imágenes para la evaluación del diafragma (1). La técnica de evaluación de la función diafragmática mediante uso de la ecografía es sencilla con una curva de aprendizaje corta. En pacientes adultos, un estudio informó que la capacitación de los operadores de ultrasonido para identificar el diafragma y medir su grosor toma de tres a cinco sesiones que duran entre 10 y 15 minutos cada una (3, 4). El espesor del diafragma se mide habitualmente en la zona de aposición del diafragma a la caja torácica; en la evaluación en modo B, se accede a los hemidiafragmas a través de los espacios intercostales. Con el paciente en decúbito supino, se utiliza una sonda lineal multifrecuencia (7-18 MHz) posicionada en el plano longitudinal en la línea axilar anterior, entre el 7º y 8º o 8º y 9º espacios intercostales. Las evaluaciones se realizan en la zona de aposición, donde el diafragma se apoya en la caja torácica inferior (4) (Figura 2). El diafragma normal es visualizado entre dos líneas ecogénicas (Figura 3): la de la pleura parietal y la de la membrana peritoneal. Durante la inspiración, la musculatura de un diafragma sano se contrae y las fibras se acortan con aumento del volumen muscular y espesor consecuente. En la evaluación en modo M, podemos obtener la fracción de acortamiento del diafragma definida como grosor inspiratorio – espesor espiratorio / espesor inspiratorio × 100, que cuantifica el grado de engrosamiento muscular, siendo definida como disminuida cuando este resultado es menor del 30% (1, 2, 4). Se ha encontrado que la fracción de acortamiento es un índice preciso de la carga de trabajo de los músculos respiratorios. Una revisión sistemática sobre la literatura actual que evalúa la utilidad y la precisión del uso de la ecografía para evaluación de función diafragmática en pacientes de unidades de cuidados intensivos incluyó veinte estudios. La ecografía se realizó con diferentes técnicas para medir la excursión inspiratoria diafragmática, el espesor del diafragma y la fracción de acortamiento. Los límites óptimos que incluyen los estudios de este meta-análisis variaron de 10 a 14 mm para la excursión y 30-36% para la fracción de acortamiento. Concluye que el manejo de la ecografía con esta finalidad es factible, altamente reproducible y permite detectar la disfunción diafragmática en el paciente crítico (4). El uso de la ecografía torácica no solo ha demostrado superioridad en el diagnóstico diferencial de la disnea y la insuficiencia respiratoria de origen neuromuscular frente a las técnicas convencionales sino que además ha supuesto un cambio de actitud terapéutica al poder incorporar su uso para optimizar el manejo del destete de la ventilación mecánica al ingreso del paciente en las unidades de cuidados intensivos (5). Varias publicaciones apoyan el hecho de que en el destete de la ventilación mecánica y las pruebas de respiración espontánea, tanto la excursión diafragmática como las mediciones de engrosamiento diafragmático se han utilizado para predecir el éxito o el fracaso de la extubación (4, 6, 7). En general, la ecografía es una modalidad de diagnóstico clínicamente valiosa pero tiene potenciales limitaciones. La imagen por ultrasonido ha sido criticada tradicionalmente por ser observador dependiente. Además determinadas consideraciones anatómicas deben tenerse en cuenta como que la excursión hacia abajo del pulmón y la ventana más pequeña del bazo a la izquierda son dos posibles impedimentos para la visualización exitosa de ese hemidiafragma. Un escollo encontrado en la ecografía en pacientes con grandes derrames pleurales es la presencia de un movimiento diafragmático paradójico cuando los pacientes se examinan en posición de pie, lo que típicamente sugiere parálisis. Se ha informado que este hallazgo vuelve al movimiento normal cuando se realiza una ecografía con el paciente en decúbito supino y por lo tanto se recomienda esa posición. También se han notificado movimientos paradójicos de un diafragma no paralizado en el hidrotórax, neumotórax a presión negativa, pulmón fibrosis, atelectasia y absceso subfrénico (7,8). Otra limitación del uso generalizado de la ecografía para la evaluación del diafragma es la falta de valores de referencia para los parámetros del diafragma en pacientes con enfermedad pulmonar o neuromuscular, porque hay diferentes rangos de volúmenes pulmonares para la respiración tranquila, la respiración profunda o las maniobras de inspiración. Según la posición corporal, el peso, la altura, la enfermedad pulmonar subyacente, o la condición física del sujeto, se ha demostrado que los músculos superiores de la caja torácica y del cuello contribuyen en mayor medida al volumen inspirado en ciertos sujetos (8). Por ultimo reseñamos que los parámetros de ultrasonido del espesor y la excursión también pueden variar dependiendo del punto de medición inicial que escogemos como fin de expiración o comienzo de la inspiración.
Conclusiones
La ecografía del diafragma tiene su aplicación principalmente en pacientes en cuidados intensivos. En tales pacientes la evaluación del diafragma por ultrasonidos se puede utilizar para hacer un diagnóstico diferencial rápido de la disnea, predecir con éxito destete de la ventilación mecánica y adecuar las decisiones con respecto a ajustes en los parámetros de ventilación mecánica, controlar la carga de trabajo respiratorio y para investigar la debilidad o parálisis diafragmática asociada a determinadas cirugías y lesiones traumáticas. Se necesitan más estudios que establezcan valores de referencia para el espesor del diafragma, la amplitud de la excursión y la velocidad que tienen en cuenta la fase del ciclo respiratorio. En conclusión, la ecografía es una técnica prometedora para la evaluación de la estructura y la función dinámica del diafragma. Es preciso, reproducible y relativamente fácil de aprender. El hecho de que no requiera traslado o movilización del paciente para su realización es muy importante para pacientes críticamente enfermos con ventilación mecánica. En un futuro debería valorarse la ecografía como la modalidad de elección para la evaluación de la parálisis del diafragma, especialmente en pacientes neonatales, pediátricos y en estado crítico.
Bibliografía
1. Gerscovich EO, Cronan M, McGahan JP, Jain K, Jones CD, McDonald C. Ultrasonographic evaluation of diaphragmatic motion. J Ultrasound Med 2001;20:597–604. ( PubMed ) ( HTML ) ( PDF ) 2. Sarwal A, Walker FO, Cartwright MS. Neuromuscular ultrasound for evaluation of the diaphragm. Muscle Nerve. 2013 Mar;47(3):319-29. ( PubMed ) ( HTML ) ( PDF ) 3. DiNino E, Gartman EJ, Sethi JM, McCool FD. Diaphragm ultrasound as a predictor of successful extubation from mechanical ventilation.Thorax. 2014 May;69(5):423-7. ( PubMed ) ( HTML ) ( PDF ) 4. Zambon M, Greco M, Bocchino S, Cabrini L, Beccaria PF, Zangrillo A. Assessment of diaphragmatic dysfunction in the critically ill patient with ultrasound: a systematic review.Intensive Care Med. 2017 Jan;43(1):29-38. ( PubMed ) 5. Serna Gandía M, Vicho Pereira R, Cuesta Montero P, Carpi Femenía I, Benlloch Beitia A. Ultrasonografía en UCI. Rev electron Boletín SCI 2016; Vol 2 (1): 1. ( HTML ) 6. Matamis D, Soilemezi E, Tsagourias M, Akoumianaki E, Dimassi S, Boroli F et al. Sonographic evaluation of the diaphragm in critically ill patients. Technique and clinical applications. Intensive Care Med. 2013;39:801–10. ( PubMed ) 7. Alexander C. Diaphragm movements and the diagnosis of diaphragmatic paralysis. Clin Radiol 1966;17:79–83. ( PubMed ) 8. Wait JL, Nahormek PA, Yost WT, Rochester DP. Diaphragmatic thickness–lung volume relationship in vivo. J Appl Physiol 1989;67: 1560–1568. ( PubMed )
Cómo citar: Charco Roca, L. M., Simón Polo, E. (2020). Evaluación ecográfica de la función diafragmática en el paciente crítico. Revista Electrónica AnestesiaR , 11 (2), 1. https://doi.org/10.30445/rear.v11i2.659
¿Quieres que te informemos de los temas más interesantes sobre Anestesia, Críticos, Urgencias y Dolor?
Una vez al mes te resumimos la actualidad médica según tus intereses.

Recomendaciones de manejo de la Gripe A en la Unidad de Cuidados Críticos
You may also like.

Claves para liderar la seguridad en anestesia

Programas hospitalarios para tratar la ansiedad infantil. Revisión de las evidencias (II/II)

Manejo de la agitación y sedación en Unidades de Críticos. ¿Alguna novedad?
Deja una respuesta cancelar la respuesta.
Tu dirección de correo electrónico no será publicada. Los campos obligatorios están marcados con *
Comentario *
Correo electrónico *
Guarda mi nombre, correo electrónico y web en este navegador para la próxima vez que comente.
Al usar este formulario aceptas nuestra Política de Privacidad y la forma en la que almacenamos y gestionamos tus datos
Sí, suscríbeme a las entradas por correo.
Este sitio usa Akismet para reducir el spam. Aprende cómo se procesan los datos de tus comentarios .
More Stories
La duración de la intubación con fibroscopio se incrementa con la presión cricoidea. Un estudio randomizado doble ciego

Consulte los artículos y contenidos publicados en éste medio, además de los e-sumarios de las revistas científicas en el mismo momento de publicación
Esté informado en todo momento gracias a las alertas y novedades
Acceda a promociones exclusivas en suscripciones, lanzamientos y cursos acreditados
Estamos experimentado problemas con el acceso a las cuentas de usuarios. Disculpe la molestias
- I have forgotten my password

Open Respiratory Archives is one of the official publications from the Spanish Respiratory Society of Pulmonology and Thoracic Surgery (SEPAR) and a companion title to the highly-regarded Archivos de Bronconeumología. Open Respiratory Archives is a new online only, open access, peer reviewed journal that publishes original studies whose content is based upon results dealing with several aspects of respiratory diseases such as epidemiology, pathophysiology, clinics, surgery and basic investigation. Other types of articles such as reviews, editorials, clinical images, scientific letters, and letters to the Editor are also published in the Journal. In addition, the Journal may also publish society documents such as guidelines, position documents, statements, and consensus reports as long as redundancy with previous publications in other society journals does not exist or the degree of similarity is low. Authors of this type of society documents must prove scientific accreditation in the target areas. All the manuscripts received in the Journal are sent to peer-review and are handled by the Editor or an Associate Editor from the team. The official languages of the Journal are English and Spanish. Therefore, manuscripts can be submitted in either language. The areas covered in the Journal are of general interest to the average clinician dealing with respiratory patients, especially pulmonologists and thoracic surgeons. Other types of professionals may also find the contents published in the Journal of interest for their clinical practice: internists, radiologists, immunologists, physiotherapists, rehabilitators, primary care doctors, nurses, and other professionals.
Indexed in:
Scopus, PubMed Central, DOAJ and Embase.
CiteScore measures average citations received per document published.
SRJ is a prestige metric based on the idea that not all citations are the same. SJR uses a similar algorithm as the Google page rank; it provides a quantitative and qualitative measure of the journal's impact.
SNIP measures contextual citation impact by wighting citations based on the total number of citations in a subject field.
- Palabras clave
- Introducción
- Búsqueda de estudios
- Criterios de selección y medidas de resultados
- Extracción de datos y evaluación de la calidad
- Análisis estadístico
- Descripción de los estudios
- Calidad de los estudios incluidos
- Limitaciones del estudio
- Conclusiones
- Financiación
- Conflicto de intereses
- Agradecimientos
- Bibliography
No se ha aclarado suficientemente el papel de la disfunción diafragmática estimada mediante ecografía como predictora del fracaso de la extubación.
Realizamos una revisión sistemática y metaanálisis de estudios observacionales que incluyeron pacientes intubados sometidos a ventilación mecánica (VM), a los que se realizó una ecografía diafragmática uni- o bilateral para evaluar la disfunción diafragmática antes de la extubación. Se efectuó una búsqueda en las bases de datos Pubmed y Embase entre el primero de enero de 2010 y el 30 de junio de 2019, utilizando los términos diaphragm ultrasound , diaphragm ultrasonography , weaning y extubation . Definimos fracaso del destete como la necesidad de reintubación y soporte con VMI o fracaso de la prueba de respiración espontánea (PRE). Se utilizaron como medidas ecográficas para predecir el fracaso del destete en pacientes intubados sometidos a VM la excursión diafragmática (ED), la fracción de engrosamiento diafragmático (FEG), el tiempo hasta la amplitud del pico inspiratorio del diafragma (TAPI dia), puntuación de ultrasonido pulmonar modificada (PUPm) y el índice de tiempo de excursión diafragmática (ITED). Secundariamente, evaluamos su utilidad para predecir la muerte por cualquier causa, la duración de la estancia hospitalaria y la necesidad de ventilación no invasiva (VMNI) o de oxigenoterapia de alto flujo tras el destete. Para la agregación de datos se utilizó un modelo de efectos aleatorios, la odds ratio (OR) y sus intervalos de confianza (IC) del 95%. La heterogeneidad de los estudios originales se evaluó mediante el estadístico I 2 . En todos los análisis, los niveles de significación fueron bilaterales y se consideraron significativos los valores de p < 0,05.
Incluimos un total de 18 estudios prospectivos que reclutaron 1.229 pacientes intubados sometidos a VM. El destete fracasó en 254 de los 490 (52%) pacientes con disfunción diafragmática, comparado con 117 de los 739 (16%) pacientes sin disfunción diafragmática. La presencia de disfunción diafragmática evaluada por ecografía se asoció significativamente con el fracaso del destete en los siete primeros días después de la extubación (OR 8,2; IC 95%, 4,7-14,2; p < 0,0001; I 2 = 66%). Los resultados fueron consistentes para los estudios que evaluaron el diafragma de forma uni- o bilateral.
La disfunción diafragmática evaluada por ecografía se asocia al fracaso del destete en los siete primeros días después de la extubación.
The evaluation of diaphragmatic dysfunction by ultrasound as a predictor of extubation failure lacks of standardization.
We performed a systematic review and meta-analysis of studies that included patients intubated on mechanical ventilation, and who received unilateral or bilateral diaphragmatic ultrasound to evaluate diaphragmatic dysfunction prior to extubation. We searched the Pubmed and Embase databases from January 1, 2010 to June 30, 2019 using the terms «diaphragm ultrasound, diaphragm ultrasonography», «weaning» and «extubation». We defined weaning failure as the need of intubation with invasive ventilacion or failure in spontaneous breathing trial (SBT). The echographic measures used for predicting weaning failure in intubated patients were diaphragmatic excursion (DE), diaphragm thickening fraction (DTF), time to peak inspiratory amplitude of the diaphragm (TPIA dia), modified lung ultrasound score (LUSm) y el excursion time index (ET index).We evaluated the usefulness of ultrasound-assessed diaphragmatic dysfunction to predict the primary outcome of weaning failure in intubated patients undergoing mechanical ventilation. Secondary outcomes were mortality, hospital stay and the need for noninvasive ventilation or high-flow oxygen therapy after weaning in this group of patients. Random effects model, odds ratio (OR), and 95% confidence intervals (CI) were used for data aggregation. The heterogeneity of the original studies was evaluated using the I2 statistic. In all analyses, significance levels were bilateral and p values < 0.05 were considered significant.
We included a total of 18 prospective studies that recruited 1 229 intubated patients on mechanical ventilation. Weaning failed in 254 of the 490 (52%) patients with diaphragmatic dysfunction, compared with 117 of the 739 (16%) patients without diaphragmatic dysfunction. The presence of ultrasound-assessed diaphragmatic dysfunction was significantly associated with weaning failure within 7 days after extubation (18 cohorts, 1 229 patients; odds ratio [OR] 8.2; 95% confidence interval [CI], 4.7-14,2; p < 0.0001; I 2 = 66%). The results were consistent for studies that performed unilateral or bilateral assessment of diaphragmatic function.
Diaphragmatic dysfunction evaluated by ultrasound is significantly associated with weaning failure in the first 7 days after extubation.
A pesar de ser una intervención eficaz para el mantenimiento de la vida de los pacientes críticos, la ventilación mecánica (VM) produce complicaciones entre el 18 y el 80% de los pacientes 1 , por lo que es deseable su suspensión (i.e., destete) tan pronto como el enfermo sea capaz de mantener una respiración espontánea.
Actualmente las guías de práctica clínica recomiendan la realización de una prueba de respiración espontánea (PRE) como herramienta para predecir un destete exitoso en pacientes intubados sometidos a VM 1 . Se trata de una prueba en la que se evalúa la capacidad del paciente para respirar espontáneamente con el mínimo soporte respiratorio posible. Habitualmente se realiza utilizando un modo de ventilación de presión soporte (PSV) o una prueba de pieza en T. Se puede proceder al destete si el paciente puede mantener el intercambio gaseoso a mínimos niveles de presión de soporte (generalmente de 5-10 cm H 2 O) o con la pieza en T. Sin embargo, esta prueba no está convenientemente estandarizada y la decisión sobre el momento de realizarla varía de unas Unidades a otras. Además, entre un 13 y un 26% de los pacientes que son extubados por una PRE positiva necesitan ser reintubados en las primeras 48 horas tras el destete 2,3 .
El uso de la ecografía se está extendiendo progresivamente en las Unidades de Cuidados Intensivos (UCI) debido a su portabilidad, velocidad y seguridad para el manejo de distintos procesos 4 . Como la disfunción del diafragma predispone a complicaciones respiratorias que pueden prolongar la duración de la VM, y como la ecografía proporciona información morfológica y funcional en tiempo real, esta técnica podría ser útil para evaluar la función del diafragma y para decidir el momento preciso de la extubación 4,5 . Debido a la falta de consenso sobre el procedimiento de la técnica y a la falta de estandarización de los puntos de corte para definir la disfunción diafragmática, los estudios individuales han proporcionado resultados contradictorios 6-8 .
El objetivo principal de esta revisión sistemática y metaanálisis fue evaluar la utilidad de la disfunción ecográfica del diafragma para predecir el fracaso del destete en pacientes intubados sometidos a VM. Secundariamente, evaluamos la utilidad de la disfunción ecográfica del diafragma para predecir la muerte por cualquier causa, la duración de la estancia hospitalaria y la necesidad de ventilación no invasiva (VMNI) o de oxigenoterapia de alto flujo tras el destete en este grupo de pacientes.
El protocolo de la revisión sistemática fue registrado en la base de datos International Prospective Register of Systematic Reviews (PROSPERO) database (CRD42020141538).
Dos investigadores (AG-S y EB) realizaron búsquedas sistemáticas independientes en las bases de datos PubMed y Embase de artículos elegibles publicados entre el primero de enero de 2010 y el 30 de junio de 2019. Las discrepancias entre los dos investigadores se resolvieron con la ayuda de un tercer investigador (IG). Las búsquedas se efectuaron con la siguiente estrategia: diaphragm ultrasound OR diaphragm ultrasonography AND weaning OR extubation , incluyendo artículos en inglés y español. La revisión sistemática se completó mediante una búsqueda manual de la bibliografía.
El metaanálisis incluyó los estudios que cumplían los siguientes criterios de selección: 1) estudios observacionales retrospectivos o prospectivos; 2) población: pacientes intubados sometidos a VM; 3) intervención: evaluación de la disfunción del diafragma mediante ecografía en la fase de destete; 4) variables de resultados: necesidad de reintubación en los siete primeros días después del destete como variable principal; y mortalidad por cualquier causa, duración de la estancia hospitalaria, necesidad de VMNI o de oxigenoterapia de alto flujo en los siete primeros días después del destete como variables secundarias.
Se excluyeron los artículos que no incluían la reintubación como variable de resultados o en los que no constaban datos exactos para su evaluación. Para las publicaciones duplicadas, sólo se incluyó la más reciente.
Para cada estudio dos investigadores (AG-S y EB) extrajeron datos referidos a las características basales de los pacientes, resultados de la ecografía y número de eventos para cada grupo. En ausencia de información sobre los eventos en cada grupo, se contactó con el autor correspondiente para obtenerla. Las discrepancias se resolvieron con la ayuda de un tercer investigador (IG). Se utilizó la herramienta Quality in Prognosis Studies (QUIPS) para evaluar la calidad de los estudios elegidos 9 .
El metaanálisis se llevó a cabo de acuerdo con las recomendaciones Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) 10 . Para el análisis de los datos se utilizó el programa informático Review Manager (RevMan) 5.3.5 (Cochrane Collaboration, Copenhague), que ofrece paquetes estadísticos de código abierto para metaanálisis. Para la agregación de datos se utilizó un modelo de efectos aleatorios y en el resumen se utilizaron odds ratio (OR) y sus intervalos de confianza (IC) del 95%. La heterogeneidad de los estudios originales se evaluó mediante el estadístico I 2 . Usamos la prueba de Begg para determinar el sesgo de publicación. En todos los análisis, los niveles de significación fueron bilaterales y se consideraron significativos los valores de p < 0,05. Definimos el fracaso del destete como la necesidad de reintubación y soporte con VMI o fracaso de la prueba de respiración espontánea (PRE). Realizamos subanálisis según: 1) el diafragma evaluado mediante ecografía (uni- o bilateral); y 2) la definición ecográfica de disfunción diafragmática, es decir, excursión diafragmática (ED) versus otras: fracción de engrosamiento diafragmático (FEG), tiempo hasta la amplitud del pico inspiratorio del diafragma (TAPI dia), puntuación de ultrasonido pulmonar modificada (PUPm) e índice de tiempo de excursión diafragmática (ITED). Calculamos la sensibilidad, especificidad, y valores predictivos positivo y negativo para cada una de dichas medidas.
La ED se mide con el modo ecográfico M y se define como la diferencia del desplazamiento del diafragma al final de la inspiración y al final de la espiración. La FEG se calcula como el tanto por ciento que se obtiene con la siguiente fórmula: engrosamiento diafragmático al final de la inspiración menos el engrosamiento diafragmático al final de la espiración, dividido entre el engrosamiento al final de la espiración. La TAPI dia se define como el tiempo desde el inicio de la contracción diafragmática hasta la máxima amplitud de la excursión diafragmática medido con el modo M de la ecografía. El PUPm es un sistema de puntuación que distingue cuatro patrones de ventilación: normal (líneas A y deslizamiento pulmonar), pérdida moderada de ventilación pulmonar (más de dos líneas B), pérdida grave de ventilación pulmonar (múltiples líneas B fusionadas) y consolidación pulmonar (patrón ecográfico de tejido). Evalúa cuatro regiones pulmonares en lugar de las clásicas seis regiones para evitar movilizar al paciente crítico. El ITED es el producto de la excursión diafragmática y el tiempo inspiratorio 11-13 .
De 5.221 artículos evaluados, 68 fueron potencialmente elegibles y se sometieron a una revisión en profundidad. De ellos, 50 fueron excluidos por lo que finalmente se incluyeron 18 estudios con 1.229 pacientes 5,14-30 ( fig. 1 ). La prueba de Begg no evidenció sesgo de publicación.

Diagrama de flujo según las recomendaciones PRISMA.
Todos los estudios fueron prospectivos. La edad y el sexo de los pacientes incluidos fue similar en los estudios identificados excepto en el de Huang et al., que incluyó pacientes de edad más avanzada 26 ( tabla 1 ). El seguimiento osciló entre 48 5,14,16-30 y 72 horas 27 y siete días después de la extubación 15 . Los criterios de disfunción ecográfica del diafragma están reflejados en la tabla 2 . Cuatro estudios 5,19,20,29 evaluaron la disfunción del diafragma derecho, mientras que 14 evaluaron ambos diafragmas 14,21-28,30 . Once de los estudios incluidos utilizaron la ED como medida de disfunción diafragmática 15,16,18,22-28,30 . Los siete estudios restantes utilizaron la FEG 5,14,21,29 , el TAPI dia 17 , la PUPm 19 o el ITED 20 . Sólo cuatro de los estudios evaluaron objetivos secundarios de este metaanálisis: duración de la estancia hospitalaria o mortalidad por cualquier causa 25-27,30 . Ningún estudio evaluó la necesidad de VMNI u oxigenoterapia de alto flujo durante el seguimiento después de la extubación.
Características de los estudios incluidos
AUC: área bajo la curva; DD: disfunción diafragmática; ED: excursión diafragmática; ET index: índice de excursión diafragmática-tiempo; FEG: fracción de engrosamiento diafragmático; ITED: índice de tiempo de excursión diafragmática; MRC: Medical Research Council; MHz: Megahercios; N/A: no aplica; PI max: presión inspiratoria máxima; PRE: prueba de respiración espontánea;PS: presión soporte; PUPm: puntuación de ultrasonido pulmonar modificada; TAPI dia: tiempo hasta la amplitud del pico inspiratorio del diafragma; VM: ventilación mecánica.
Criterios de disfunción diafragmática
ED: excursión diafragmática; FEG: fracción de engrosamiento diafragmático; PUPm: puntuación de ultrasonido pulmonar modificada; TAPI dia: tiempo hasta la amplitud del pico inspiratorio del diafragma.
En lo relacionado con la calidad de los estudios incluidos ( tabla 3 ), la participación y las características basales de los pacientes fueron descritas de forma adecuada en todos los estudios 5,14-30 . Todos los estudios describieron adecuadamente los criterios de disfunción ecográfica del diafragma. Se realizaron ajustes por posibles confusores en ocho de los estudios incluidos 15,17,19,21,23,25,28,29 . Ninguno de los estudios dispuso de un comité independiente para la asignación de eventos.
Calidad de los estudios incluidos en el metaanálisis *
La evaluación de estos criterios se realizó según las recomendaciones de Hayden JA et al. 9 .
De las 18 cohortes con 1.229 pacientes intubados sometidos a VM, 490 (40%; IC 95%, 37-43%) pacientes tenían disfunción ecográfica del diafragma. Doscientos cincuenta y cuatro de los 490 pacientes con disfunción del diafragma fueron reintubados en los primeros siete días o fracasaron en la prueba PRE (52%; IC 95%, 47-56%), comparado con 117 de los 739 pacientes sin disfunción del diafragma (16%; IC 95%, 14-17%). La prevalencia de disfunción ecográfica del diafragma osciló entre el 16 17 y el 63% 25 .
A partir de los resultados de los 18 estudios observacionales se estimó que la OR combinada del fracaso del destete de los pacientes con disfunción diafragmática era de 8,2 (IC 95%, 4,7-14,2; p 2 = 66%) ( fig. 2 ). Se objetivó una mayor necesidad de reintubación en los pacientes con disfunción del diafragma excepto en dos estudios 15,16 .

Fracaso del destete en pacientes con disfunción ecográfica del diafragma.
Los resultados fueron similares cuando el análisis se limitó a los 14 estudios (978 pacientes) que evaluaron ambos diafragmas (OR 6,9; IC 95%, 3,6-13,4), con evidencia de heterogeneidad (p 2 = 69%) ( fig. 3 A), y cuando el análisis se realizó con los cuatro estudios (251 pacientes) que evaluaron un solo diafragma (OR 12,8; IC 95%; 6,6-24,8; p 2 = 0%) ( fig. 3 B).

Fracaso del destete en pacientes con disfunción ecográfica del diafragma. A) Evaluación de ambos hemidiafragmas. B) Evaluación de un solo diafragma.
Para los 11 estudios que utilizaron la ED como medida de disfunción diafragmática 13,14,16,20-26,28 , se obtuvo una OR combinada para esta medida de 4,9 (IC 95%, 2,5-9,6; p 2 = 65%) ( fig. 4 A). Las medidas ecográficas de la ED que predicen fracaso del destete difieren en los estudios incluidos encontrando valores entre 7 mm 28 y 27 mm 24 . Para los cuatro estudios que usaron FEG, el OR fue de 27,4 (IC 95%, 12,3-60,3; p = 0,89, I 2 = 0%) ( fig. 4 B). Para los tres estudios que utilizaron otra medida ecográfica (TAPI dia, PUPm, ITED), el OR fue de 10,11 (IC 95%, 4,9-20,9; p = 0, 80, I 2 = 0%) ( fig. 4 C).

Fracaso del destete en pacientes con disfunción ecográfica del diafragma. A) Evaluación mediante la excursión diafragmática. B) Evaluación ecográfica mediante la fracción de engrosamiento diafragmático. C) Evaluación mediante otras medidas ecográficas.
La sensibilidad y especificidad de la ecografía diafragmática fueron 68,4% (63,4-73,1; p fig. 5 A). Para la ED la sensibilidad fue de 65,9% (59,7-71,6; p fig. 5 B). Para la FEG la sensibilidad fue de 78,3% (65,4- 87,5; p fig. 5 ) y para las otras medidas ecográficas (TAPI dia, PUPm, ITED) 69,6% (55,7-80,8; p fig. 5 D).

Sensibilidad, especificidad, valor predictivo positivo y negativo de cada una de las medidas ecográficas. A) Datos globales de la ecografía diafragmática. B) Excursión diafragmática (ED). C) Fracción de engrosamiento diafragmático (FEG). D) Otras medidas (TAPI dia, PUPm, ITED).
Cuatro estudios (232 pacientes) proporcionaron información sobre las variables de resultado secundarias 23,24,25,28 ( tabla 4 ). Veintiocho pacientes fallecieron por cualquier causa en el grupo de disfunción diafragmática (24%; IC 95%, 16-32%), comparado con 22 en el grupo sin disfunción diafragmática (18%; IC 95%, 11-25%). La OR combinada de mortalidad fue de 1,8 (IC 95%, 0,6-5,7; p = 0,33; I 2 = 47%) para los pacientes con disfunción diafragmática ( fig. 6 ).
Eventos observados en los primeros siete días después de la extubación según la presencia o ausencia de disfunción del diafragma (p < 0,05)
DE: desviación estándar.

Mortalidad precoz en pacientes con disfunción ecográfica del diafragma.
Los resultados fueron similares después de excluir el estudio transversal de Theereawit et al. 17 , lo que aumenta la robustez de los resultados (OR 7,9; IC 95%, 4,5-14,1).
En el presente metaanálisis de 18 cohortes que incluyeron 1.229 pacientes, a los que se realizó una ecografía diafragmática en el momento previo a la extubación, se pone de manifiesto que aquellos que presentaban disfunción ecográfica del diafragma tuvieron un riesgo ocho veces mayor de ser reintubados, comparados con los pacientes sin disfunción diafragmática. Con independencia de su diseño y del método de evaluación de la disfunción diafragmática, los estudios mostraron resultados consistentes.
La predicción del éxito de la extubación es fundamental en el manejo de pacientes críticos sometidos a VM. Sin embargo, no existe una prueba estándar oro que prediga el éxito o fracaso de la misma 1 . Se han publicado recientemente algunas revisiones sistemáticas y metaanálisis sobre la capacidad de la ecografía diafragmática para predecir el éxito del destete en pacientes sometidos a VM 6-8 . Li et al. 7 realizaron una revisión sistemática que incluyó ensayos clínicos que compararon la precisión de la ED frente a FEG a las 48 horas del destete, con el objetivo de establecer un parámetro evaluable mediante ultrasonidos para predecir el éxito del destete. Sus resultados muestran una buena sensibilidad de FEG frente a ED de 0,893 (IC 95%: 0,854-0,924) vs. 0,78 (IC 95%: 0,7-0,8) para predecir un destete exitoso. Esta diferencia puede ser explicada desde el punto de vista fisiológico ya que FEG refleja la contracción activa del diafragma durante la ventilación mecánica, mientras que la ED está relacionada con el volumen inspirado por el paciente, independientemente de si dicho volumen depende del esfuerzo muscular del paciente o del administrado por el soporte ventilatorio. Llamas-Álvarez et al. 8 analizaron la capacidad predictiva de ambas medidas ecográficas con resultados similares (área bajo la curva ROC para FEG de 0,87 frente a sensibilidad de ED de 75% (IC 95%: 65-85). Estos autores, sin embargo, plantean que aunque FEG es una medida más sensible para predecir el éxito del destete no está exenta de errores debido a que existen otros factores que pueden afectar al proceso de extubación. Entre ellos, plantean procesos que afectan al parénquima pulmonar como el edema pulmonar o las atelectasias, muy frecuentes en pacientes críticos. Por ello, plantean la utilización de medidas combinadas, como FEG y PUPm, para aumentar el valor predictivo de la ecografía diafragmática. No obstante, los ensayos clínicos con PUPm y otras medidas ecográficas para evaluar la disfunción diafragmática son escasos, por lo que no es posible extraer datos concluyentes.
Los resultados de nuestra revisión sistemática y metaanálisis coinciden con los anteriormente mencionados. El hecho de que nuestro metaanálisis haya incluido un mayor número de estudios y pacientes, los subanálisis realizados (diferencias entre la exploración de uno o ambos diafragmas; nuevas medidas ecográficas distintas a la ED) y la evaluación de eventos secundarios como la mortalidad, la duración de la estancia hospitalaria y la necesidad de uso de oxígeno suplementario o VMNI tras el destete, aumentan la fiabilidad de los resultados y avalan el uso de la ecografía diafragmática como herramienta para predecir el éxito del destete en pacientes sometidos a VM.
¿Cuáles son las implicaciones de estos resultados para la práctica clínica? Nuestros resultados indican que la evaluación del diafragma por ultrasonidos se puede utilizar antes del destete para predecir el éxito de la extubación. Dado que la técnica es sencilla, tiene una curva de aprendizaje corta, es portátil y no se asocia a radiación ionizante, las Unidades de Cuidados Intensivos y de Cuidados Intermedios Respiratorios deberían incorporarla como una herramienta rutinaria en el manejo del paciente sometido a VM.
Al tratarse de un metaanálisis de datos agregados, no se pudieron ajustar los resultados por variables de confusión 7,8 . Los metaanálisis que utilizan datos de pacientes individuales permitirían la realización de tales ajustes. Las limitaciones de cada uno de los estudios incluidos podrían haber introducido sesgos significativos en las estimaciones de este metaanálisis y del valor pronóstico de la disfunción ecográfica del diafragma. La restricción del idioma podría haber excluido estudios relevantes para este metaanálisis, aunque parece poco probable que hubiera modificado de forma significativa los resultados de este estudio. Ninguno de los estudios dispuso de un comité ciego independiente que asignara los eventos analizados. Debido que no está validada de forma internacional una técnica ecográfica que prediga el éxito del destete en pacientes con VM los estudios publicados carecen de patrón de referencia para validar la técnica ecográfica empleada, utilizando PRE como comparador 5,17,21,23,26,28-30 , la estimulación bilateral del nervio frénico 25 , comparando con la puntuación de Medical Research Council (MRC) 24 o sin comparar con otro método de predicción del destete 14-16,18-20,22,27 . La ausencia de patrón de referencia podría introducir sesgos en el valor pronóstico de la disfunción ecográfica del diafragma.
En conclusión, esta revisión sistemática y metaanálisis demuestra que la disfunción ecográfica del diafragma se asocia a un riesgo aumentado de fracaso de la extubación en pacientes sometidos a VM invasiva. Son necesarios estudios bien diseñados que evalúen si la combinación de la ecografía diafragmática con otras exploraciones, como la prueba de respiración espontánea (PRE) y la presión inspiratoria máxima (PImax), identifica con más precisión a los pacientes en los que fracasará el destete.
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Los autores no declaran no tener ningún conflicto de intereses.
A la doctora Katerina Flevari por proporcionar datos de su ensayo clínico, necesarios para este metaanálisis.
- Subscribe to our newsletter
- Instructions for authors
- Submit an article
- Ethics in publishing
- Open Access Option
- Language Editing services
- GEMA 5.3. Spanish Guideline on the Management of Asthma
- Encuesta sobre la actividad de los laboratorios de función pulmonar. Efectos durante la pandemia por SARS-CoV-2
- Prognostic Value of Diaphragmatic Ultrasound in Patients Admitted for COVID-19 Pneumonia
- Bilateral Chylothorax and COVID-19: Report Case
- Face Mask Exemptions, Respiratory Patients, and COVID-19 in Spain. Data From the 2021 ITC EUREST-PLUS Spain Survey
- Send to a friend
- Export reference
- Last published articles
- Highlighted articles
- Articles in press
- Current Issue
- Supplements
- Related journal - Archivos de Bronconeumologia
- Aims and scope
- Editorial Board
- Advertising
- Most often read
- All metrics
- Call for papers
- Artículos más leídos
- Colecciones
- Fondo editorial
- Más información
- Download PDF

Estudio sonográfico del diafragma. Una nueva herramienta diagnóstica para el anestesiólogo
Año 2018 , Artículo de Revisión , Número 2 , Volumen 47
Cecilia M. Acosta 1 , Urbano M.S. 2 , Tusman G. 1 .

1 Servicio de Anestesia, Hospital Privado de Comunidad, Mar del Plata, Buenos Aires, Argentina.
2 Servicio de Cuidados Intensivos, Clínica Pueyrredón, Mar del Plata, Buenos Aires, Argentina.
Recibido: 10-03-2018 Aceptado: 17-03-2018 ©2018 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 47 Núm. 2 pp. 110-124|https://10.25237/revchilanestv47n02.08 PDF |ePub|RIS
Diafragmatic Ultrasound, a new tool for the anesthesiologist
Point-of-care ultrasonography has become a widely used diagnostic tool in the intensive care units and during perioperative settings. Nowadays, ultrasound has been also employed to evaluate diaphragmatic function. Some advantages of this method include safety, absence of ionizing radiation, and availability of real-time bedside examinations. The aim of this review is to promote the use of diaphragmatic ultrasound assessment among anesthesiologists and intensive care physicians. This article describes the standard diaphragmatic ultrasound technique and the knowledge required in order to monitor and diagnose diaphragmatic dysfunction; emphasizing its use in the operating room and in the different fields of clinical application.
El ultrasonido point-of-care se ha convertido en una herramienta diagnóstica ampliamente utilizada en unidades de cuidados intensivos y durante el período peri-operatorio. En la actualidad, el ultrasonido esta siendo empleado además para evaluar la función diafragmática. Las ventajas de este método incluyen seguridad, ausencia de radiación ionizante y posibilidad de realizar examinación en tiempo real a la cabecera del paciente. El objetivo de esta revisión es promover el uso de la evaluación sonográfica del diafragma para médicos anestesiólogos e intensivistas. Este artículo describe la técnica estándar de la evaluación sonográfica del diafragma y el conocimiento requerido para el diagnóstico y monitorización de la disfunción diafragmática, enfatizando el uso en quirófano y en los diferentes campos de aplicación clínica.
Introducción
El diafragma presenta una estructura muscular en forma de domo que separa la cavidad torácica de la abdominal, se encuentra compuesto por fibras tipo I de baja resistencia y tipo II de contracción rápida, y su inervación esta dada por el nervio frénico que se origina de las raíces C3-C5[ 1 ]. Su parte media es tendinosa y es denominada “centro frénico”, desde donde parten fibras musculares radiadas que descienden hacia el esternón, las costillas y las vertebras lumbares. Debido a que los arcos costales anteriores son más altos que los posteriores, la inserción del diafragma es más alta en la parte anterior que posterior. Su inserción a nivel de la parte inferolateral de la caja torácica, es denominada “zona de aposición”[ 2 ]. Durante la inspiración el diafragma se contrae y provoca un desplazamiento caudal del mismo, lo que genera un aumento en la presión de la cavidad abdominal a nivel de la zona de aposición incrementando de esta manera el diámetro transverso del tórax. Constituye el principal músculo inspiratorio, siendo el responsable del incremento del 75% del volumen pulmonar durante una respiración normal, mientras que los músculos intercostales, escalenos y esternocleidomastoideo aportan el 25% restante. En pacientes de alto riesgo su disfunción puede provocar fallo respiratorio asociado a hipercapnia y en casos más severos ocasionar hipoxemia.
Dentro de las causas que generan disfunción diafragmática podemos mencionar la injuria del nervio frénico, post-operatorio de cirugía cardiaca, torácica o abdominal, asociada a bloqueo del nervio frénico durante el bloqueo del plexo braquial, enfermedades neuromusculares, metabólicas, infecciosas, disfunción diafragmática asociada al paciente crítico secundaria a polineuropatía, miopatía, drogas, etc. La ventilación mecánica puede inducir por si misma disfunción diafragmática, denominada “disfunción diafragmática inducida por el ventilador” debido a atrofia e injuria local. Existe una correlación directa entre la duración de la ventilación mecánica y el grado de atrofia muscular; por el contrario, períodos breves de actividad diafragmática durante la ventilación mecánica ya sea a través de ventilación espontánea intermitente o estimulación directa del nervio frénico limita tal atrofia. Por consiguiente, la estrategia de reducir el tiempo de ventilación controlada y promover la ventilación asistida podría ayudar a limitar la aparición de disfunción diafragmática asociada a la ventilación mecánica.
Es importante destacar que la disfunción diafragmática constituye uno de los factores determinantes en la patogénesis de las complicaciones pulmonares post-operatorias asociada a cirugías de tórax y abdomen superior. Por consiguiente, el deterioro en la reserva contráctil del diafragma puede prolongar la necesidad de asistencia ventilatoria mecánica, retrasar o conducir al fracaso del periodo de weaning y prolongar la estancia en cuidados intensivos.
Evaluación sonográfica del diafragma
Diferentes métodos permiten evaluar la función diafragmática: como la radiografía de tórax, tomografía, resonancia magnética dinámica y fluoroscopía; sin embargo, todos ellos implican el traslado del paciente critico fuera del área de cuidados intensivos, son imprácticos y algunos de ellos utilizan radiación.
La utilidad del ultrasonido (US) en modo B y M para el estudio cualitativo de la cinética diafragmática fue reportado por primera vez en el año 1975 por Harper, quien evidenció el movimiento de los órganos abdominales[ 3 ]. En los últimos años la evaluación sonográfica del diafragma ha ganado popularidad, debido a que permite valorar la función diafragmática a la cabecera del paciente, sin exponerlo a radiación ionizante y de manera rápida y no invasiva.
Se han descrito diversos métodos de exploración para evaluar la cinética diafragmática tanto de manera directa como indirecta con diferentes tipos de sondas. Las sondas de alta frecuencia 6-13 MHz son de elección para el estudio del engrosamiento diafragmático debido a que ofrecen mayor resolución en campos proximales, mientras que las sondas convex de 2-6 MHz o sectorial de 2-5 MHZ, al poseer baja frecuencia permiten el estudio de la excursión diafragmática (Figura 1). Boussuges y colaboradores, reportaron que la reproducibilidad del método intra-observador es de 96 y 94%; inter-observador de 95-91% durante ventilación espontánea para el hemidiafragma derecho e izquierdo respectivamente[ 4 ]. El US posee mayor certeza diagnostica en la evaluación de la función diafragmática que otros métodos portátiles como la fluoroscopía[ 5 ]; examina preferentemente la parte posterior y lateral del diafragma, la cual representa principalmente el componente muscular inervado por el nervio frénico, a diferencia de la fluoroscopía que estudia el área tendinosa anterior, conformada por el centro frénico que se moviliza un 40% menos con la respiración. La fluoroscopía posee además, como desventaja, la exposición repetida a radiación ionizante y la imposibilidad de evaluar pacientes con neumotórax o derrame pleural.
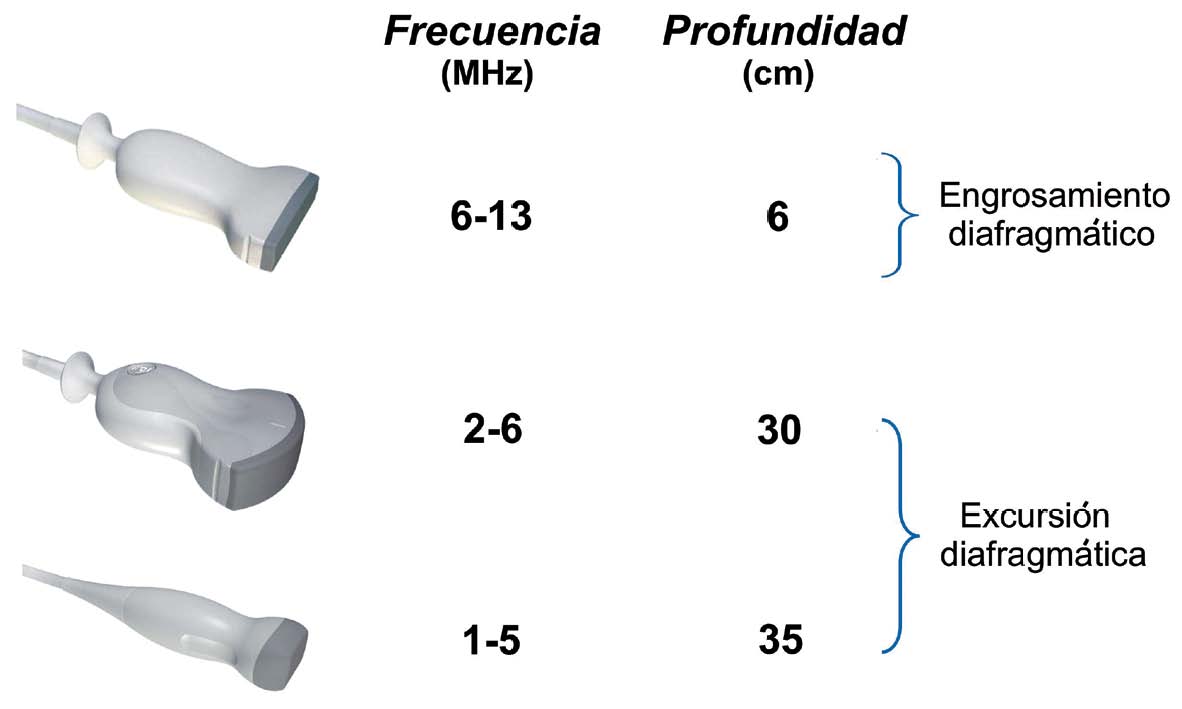
Figura 1 Sondas ecográficas empleadas para el estudio sonográfico del diafragma.
El estudio sonográfico de la función diafragmática se realiza con el paciente en posición supina, de esta manera podemos evaluar la cinética diafragmática utilizando tanto el modo B como M[ 3 ]-[ 6 ] (Vídeo 1) a través de dos metodologías diferentes (Figura 2 y 3):
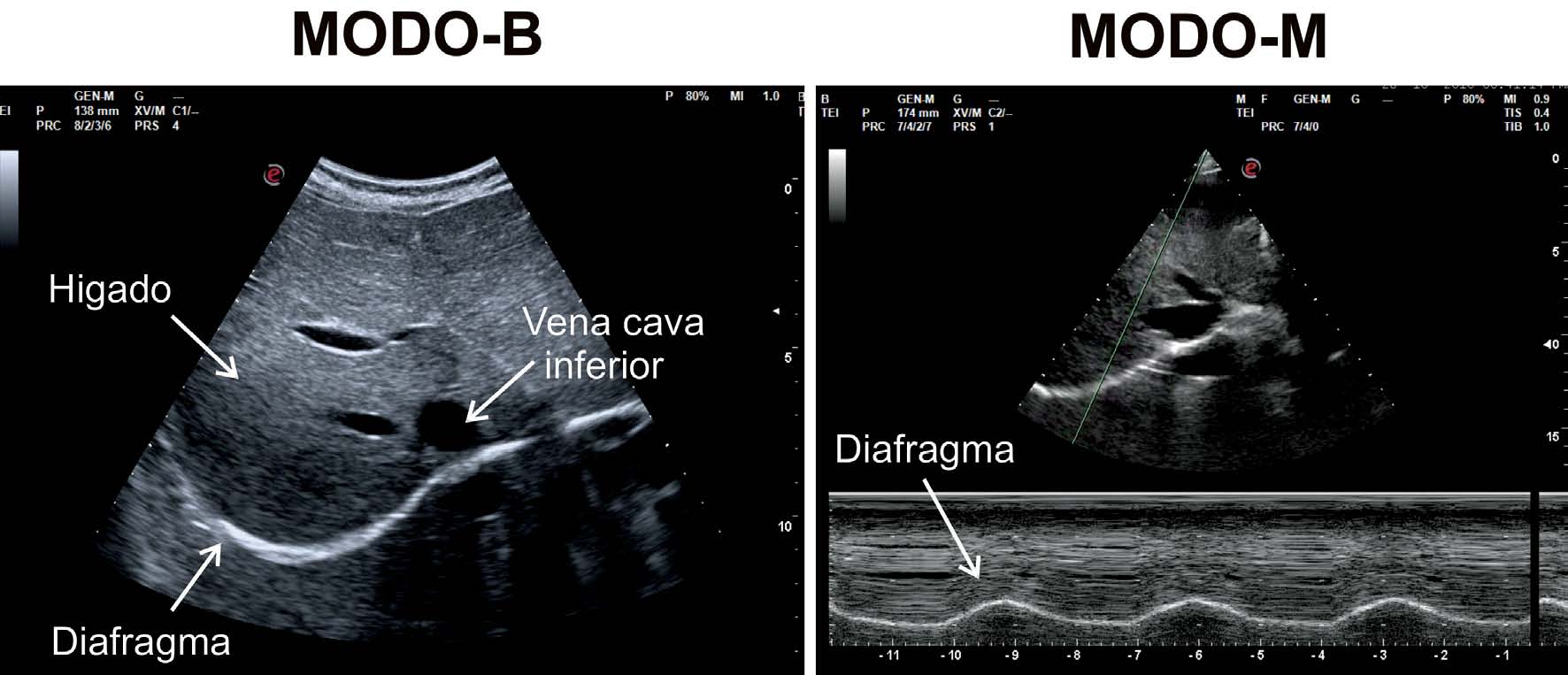
Figura 2 Modalidades ecográficas utilizadas para examinar la cinética diafragmática. A la derecha imagen obtenida usando la ventana acústica hepática, con sonda convex utilizando modo B; a la izquierda se observa el diafragma como una línea hiperecoica con movimiento sinusoidal, en modo M, con ascenso durante la inspiración y descenso en espiración.
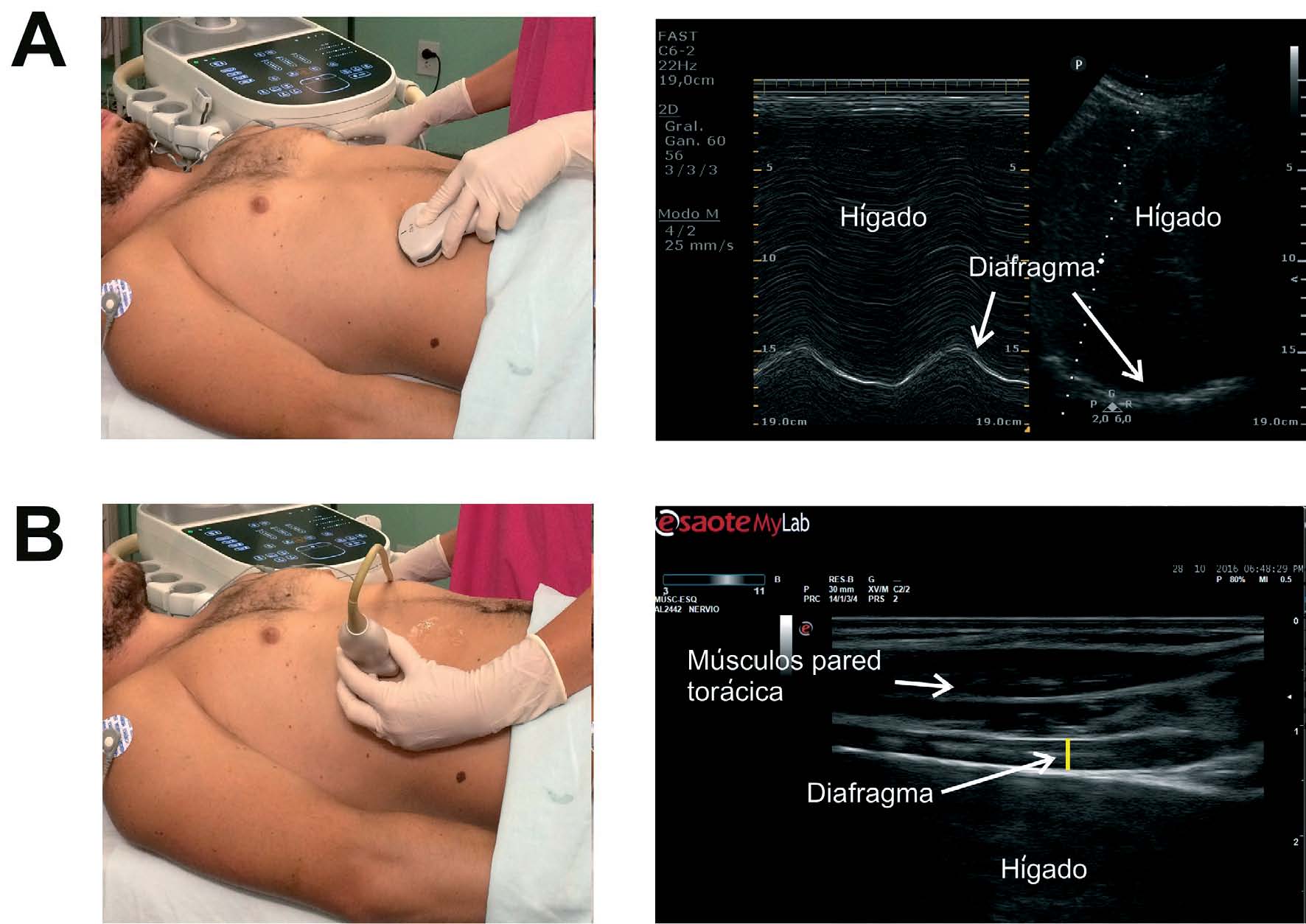
Figura 3 A: A la izquierda se observa posición de la sonda convex 2-6 MHz para escaneo del diafragma en el abordaje subcostal anterior a la altura de la línea medio-clavicular; a la derecha imagen ecográfica del diafragma en modo M y B examinando la excursión diafragmática. B: A la izquierda escaneo del diafragma en línea axilar anterior a nivel del 8°- 9° espacio intercostal “zona de aposición” con sonda lineal 6-13 MHz; a la derecha imagen sonográfica en modo B para evaluar el engrosamiento diafragmático.
• Movimiento diafragmático : examina la excursión diafragmática en tiempo real. (Vídeo 2).
• Morfología diafragmática : medición del engrosamiento del diafragma. (Vídeo 3).
A- Evaluación de la excursión diafragmática
Para estudiar la excursión diafragmática utilizaremos una sonda convex 2-6 MHz o sectorial 2-5 MHz. Existen tres abordajes diferentes (Figura 4 y 5):
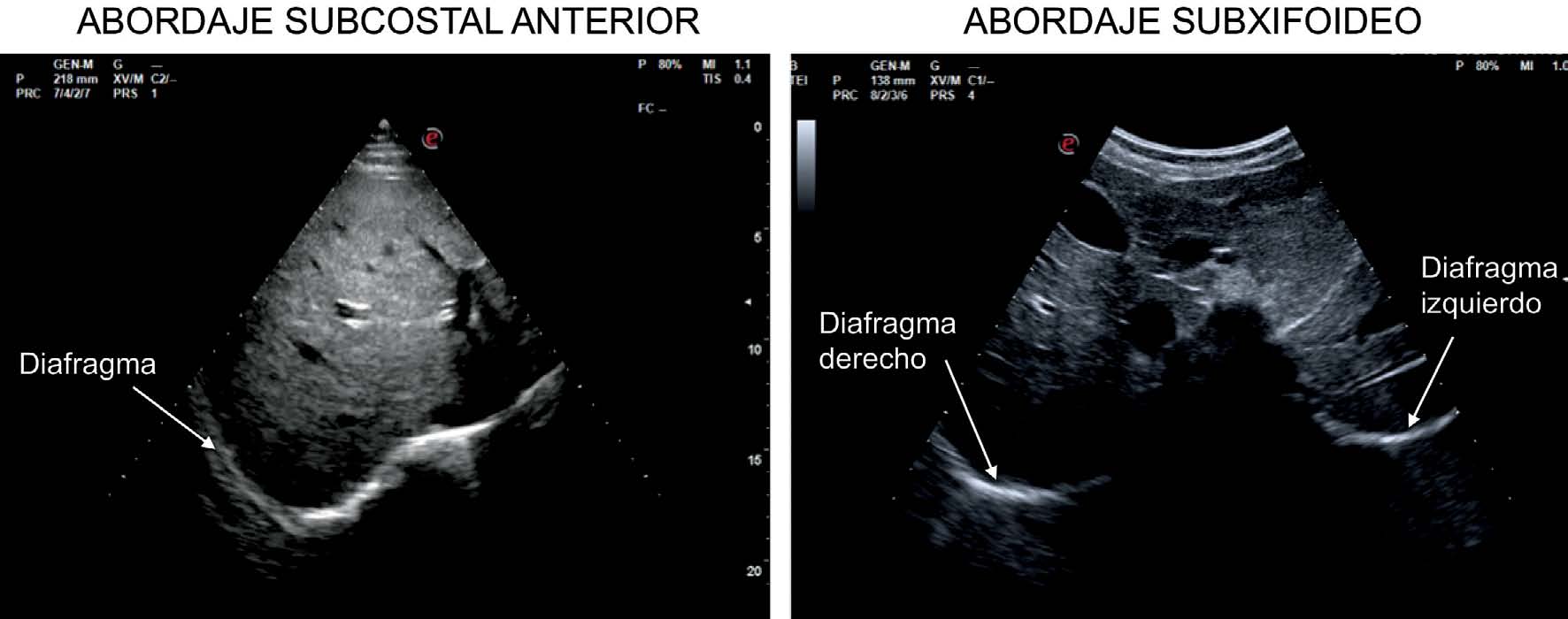
Figura 4 Principales ventanas sonográficos para el estudio del diafragma. A la izquierda imagen obtenida con sonda sectorial 2-5 MHz, utilizando la ventana subcostal a nivel de la línea medio-clavicular, se observa el hemidiafragma derecho en modo M y B A la derecha ventana subxifoidea utilizada en pacientes pediátricos, imagen obtenida con sonda convex 2-6 MHz, se observa el hemidiafragma derecho e izquierdo en modo B.
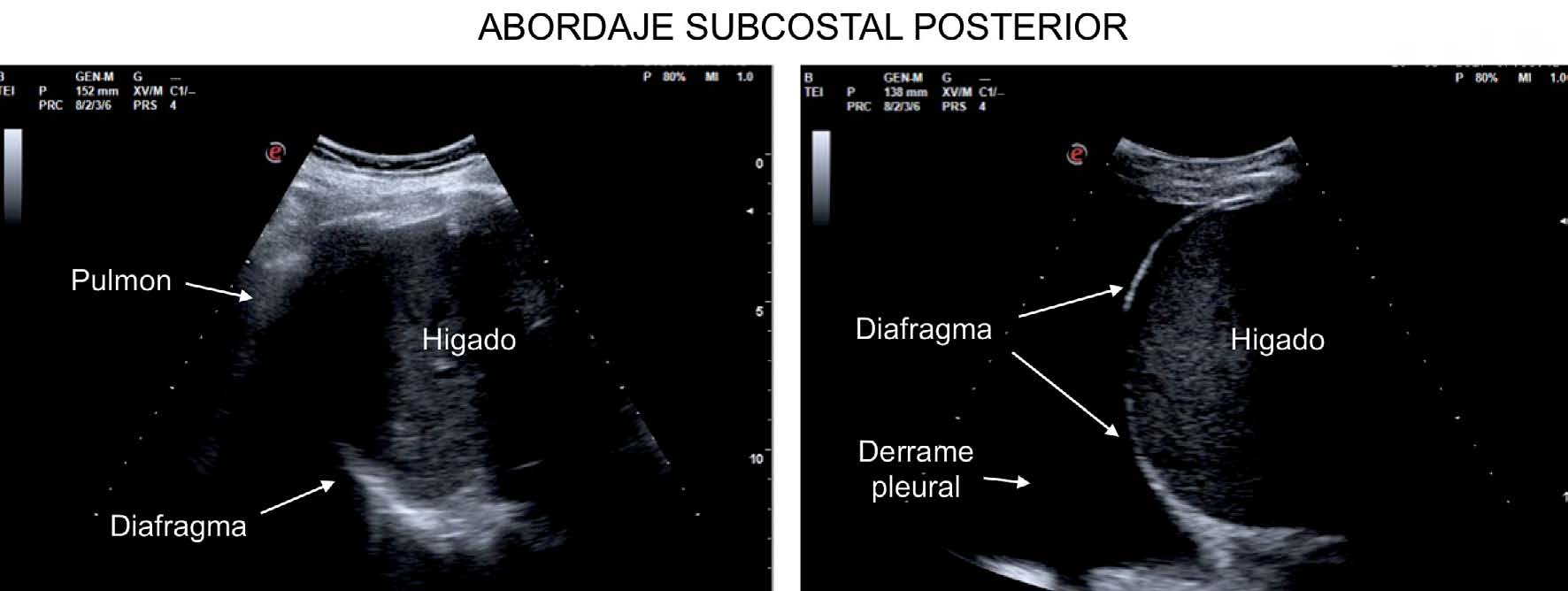
Figura 5 Abordaje subcostal posterior: imágenes obtenidas con sonda convex 2-6 MHz a nivel de la línea axilar media. A la izquierda los artefactos generados por el pulmón aireado impiden visualizar el diafragma en toda su extensión. A la derecha la presencia de derrame pleural genera una excelente ventana acústica para observar completamente el diafragma.
• Abordaje subcostal anterior : con el paciente en decúbito supino se posiciona la sonda a nivel subcostal a la altura de la línea axilar anterior o medio-clavicular, orientando la sonda en dirección cefálica y posterior. De esta forma el rayo de US alcanza la parte perpendicular del tercio posterior del hemidiafragma[ 4 ]-[ 5 ]. (Vídeo 4).
• Abordaje subcostal posterior : permite examinar el diafragma con el paciente sentado o en posición supina, presenta como limitante la imposibilidad de observar todo el diafragma cuando el pulmón se encuentra aireado en las bases debido al “signo de la cortina” (Vídeo 5).
• Abordaje subxifoideo : útil en pacientes delgados y en niños debido a que permite evaluar la excursión de ambos hemidiafragmas de manera simultánea. Con el paciente en decúbito supino se posiciona transversalmente la sonda convex debajo de la apófisis xifoides. (Vídeo 6).
Si utilizamos modo B observaremos una línea hiperecoica que representa al diafragma, que normalmente se aproximara a la sonda cuando el paciente inspira y se alejara en espiración, mientras que con el modo M observaremos un movimiento sinusoidal, con ascenso durante la inspiración y descenso en espiración.
Debido a la excelente ventana acústica que ofrece el hígado, el hemidiafragma derecho es posible de visualizar de manera mas fácil y constante, a diferencia del lado izquierdo, donde la menor ventana acústica del bazo, en algunas oportunidades, dificulta su examinación, al igual que el artefacto generado por el aire en la cámara gástrica. La presencia de derrame pleural o consolidaciones como neumonías o atelectasias optimizan la ventana acústica a nivel del abordaje subcostal posterior y anterior, lo que permiten visualizar el diafragma en toda su extensión (Figura 5) (Vídeo 5 y 7).
Para evaluar la excursión diafragmática y evitar mediciones erróneas, es importante localizar la mejor imagen en modo B orientando el transductor hacia la parte posterior del diafragma para luego trazar el modo M lo más perpendicular posible a la parte posterior del mismo. La evaluación de la excursión se puede realizar en tres momentos: durante respiración tranquila, profunda y solicitando al paciente que realice la maniobra de sniff[ 4 ]. Esta última maniobra consiste en una inspiración voluntaria rápida por la nariz con la boca cerrada, permite evaluar la fuerza contráctil del diafragma y detectar rápidamente parálisis diafragmática cuando se observa un movimiento paradójico o ausencia de movimiento. El punto de corte para definir disfunción diafragmática es una excursión < 1 cm durante respiración tranquila[ 4 ]. La dirección del trazado en modo M en el hemidiafragma paralizado permite distinguir entre paresia o parálisis observando el movimiento caudal o craneal respectivamente. Por consiguiente, en aquellos pacientes que presentan paresia, se observará una reducción del movimiento hacia caudal en inspiración estará representado en el modo M como una onda por encima de la línea de base con una excursión muy limitada, mientras que en una parálisis el movimiento será paradojal observándose una inflexión por debajo de la línea de base en el modo M[ 7 ] (Figura 6). Sin embargo, existen casos en los cuales se ha reportado un movimiento paradojal del hemidiafragma a pesar de no existir parálisis diafragmática, como en el caso de fibrosis pulmonar, atelectasias, neumotórax con presión negativa, hidrotórax y absceso subfrénico[ 8 ]. Tabla 1.
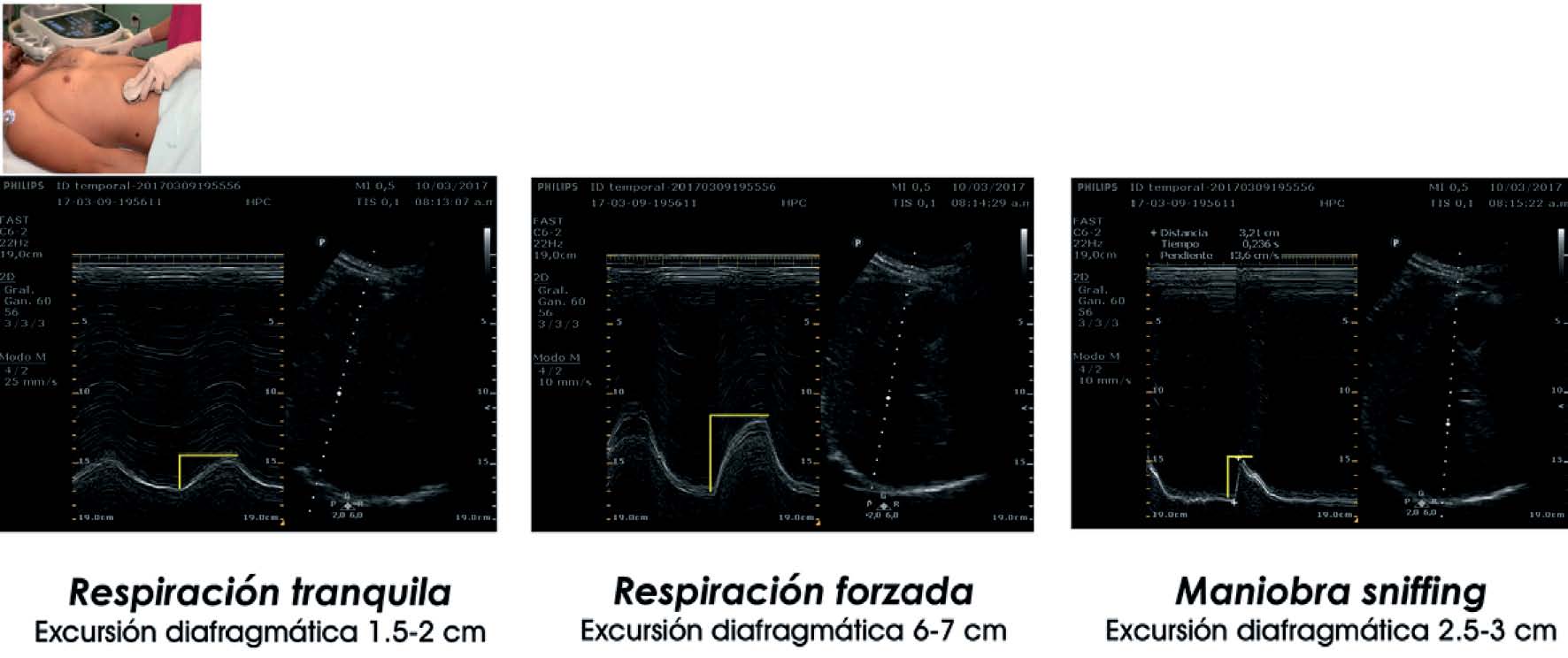
Figura 6 Excursión diafragmática utilizando la sonda convex 2-6 MHz a nivel subcostal en línea medio-clavicular, en modo M y B, durante respiración tranquila, forzada y maniobra de sniffing.
Normalmente existe una asimetría en excursión máxima de ambos diafragmas, siendo mayor excursión en el hemidiafragma izquierdo y menor en el derecho; no obstante, la excursión del hemidiafragma derecho no debe ser inferior al 50% del desplazamiento máximo del izquierdo.
Es importante tener presente que si el paciente se encuentra bajo asistencia ventilatoria, ya sea asistida o controlada, es necesario suspender momentáneamente la misma poder evaluar la función diafragmática real y evitar un sesgo en la medición, ya que de otra manera no es posible discriminar la fuerza generada por la contracción diafragmática del paciente y desplazamiento pasivo producido por la presión positiva externa.
B- Evaluación del engrosamiento diafragmático
Utilizaremos una sonda lineal de alta frecuencia 6-12 MHz.
• Abordaje intercostal : con el paciente en decúbito supino se posiciona la sonda en el 8°-9° espacio intercostal a nivel de la línea medio-axilar. Este nivel constituye la llamada “zona de aposición”, ya que el diafragma se yuxtapone con la caja torácica[5]. Observaremos al diafragma como una estructura compuesta por tres capas: dos capas hiperecoicas corresponden a la pleura diafragmática y al peritoneo, entre medio de ambas el músculo diafragmático se observa como una estructura hipoecoica. Durante la inspiración a capacidad pulmonar total observaremos un incremento en el grosor diafragmático y una disminución del mismo al final de la espiración al alcanzar el volumen residual, utilizando tanto modo B o M. (Figura 7).
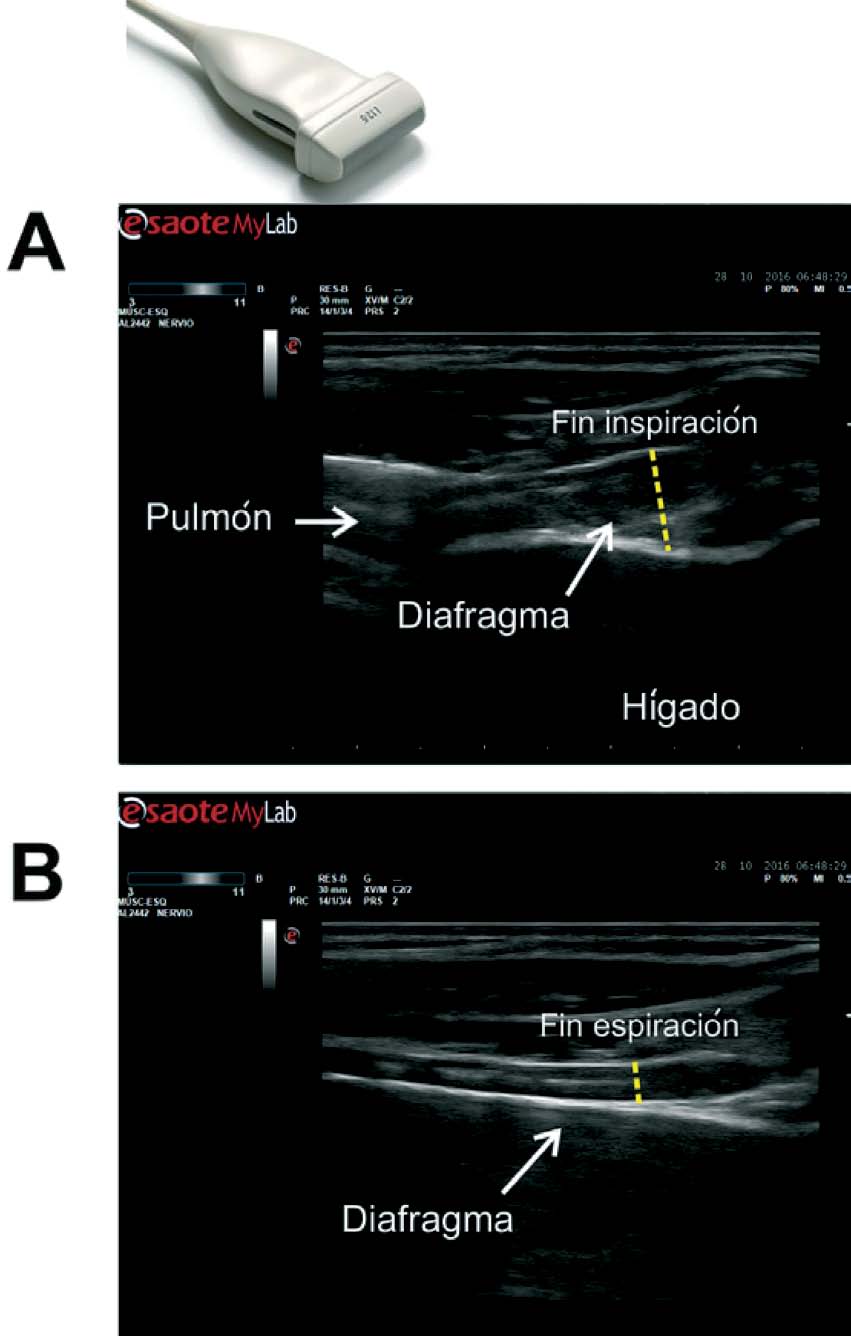
Figura 7 Evaluación del engrosamiento diafragmático utilizando sonda lineal 6-13 MHz a nivel de la “zona de aposición”. Imágenes obtenidas en modo B. A: al final de la inspiración (máximo engrosamiento), B: al final de la espiración alcanzando el volumen residual (mínimo engrosamiento).
Recientemente Tsui y colaboradores reportaron una mnemotecnia “ABCDE” que ayuda a recordar el sitio donde debemos realizar el escaneo para la evaluación del diafragma en la ventana intercostal[9]. De esta manera debemos posicionar la sonda lineal de alta frecuencia en la línea Axilar anterior a nivel del 8°-10° espacio intercostal, donde identificaremos si el paciente respira (Breathing) a través del signo del “deslizamiento pulmonar” o “lung sliding” durante el ciclo respiratorio, a continuación desplazaremos la sonda Caudalmente hasta identificar el Diafragma para poder realizar su Evaluación.
En pacientes pediátricos, dada la pequeña dimensión del tórax, este abordaje permite evaluar en un mismo escaneo varios espacios intercostales y reconocer de manera simultánea el deslizamiento pleural y movimiento diafragmático[ 10 ].
El grosor diafragmático normal medido en la zona de aposición al final de una espiración normal es de 2,2-2,8 mm, durante una inspiración máxima puede alcanzar 4 mm o más[ 11 ], en tanto que valores < 2 mm indican atrofia diafragmática. En pacientes que se encuentran bajo asistencia ventilatoria mecánica, el engrosamiento diafragmático es el indicador más confiable del esfuerzo respiratorio, ya que refleja la activación contráctil del diafragma más que el incremento del volumen torácico per se[ 12 ]; en tanto que la excursión no debería ser usada para evaluar cuantitativamente la actividad contráctil del diafragma[ 13 ].
Los cambios en el engrosamiento se evalúan a través de la fracción de engrosamiento diafragmática (FDE):
FED % = (Grosor al fin de inspiración – grosor al fin de espiración x 100)/ Grosor al fin de espiración
Utilizando el modo M es posible medir la velocidad de contracción diafragmática a través de la ventana subcostal. La misma se calcula mediante el cociente entre la excusión diafragmática durante la inspiración y el tiempo inspiratorio y se expresa en cm/segundos (Figura 8). Durante una ventilación normal la velocidad de contracción diafragmática es de 1,5 cm/seg, mientras que valores < 1 cm/seg son indicadores de disfunción diafragmática.
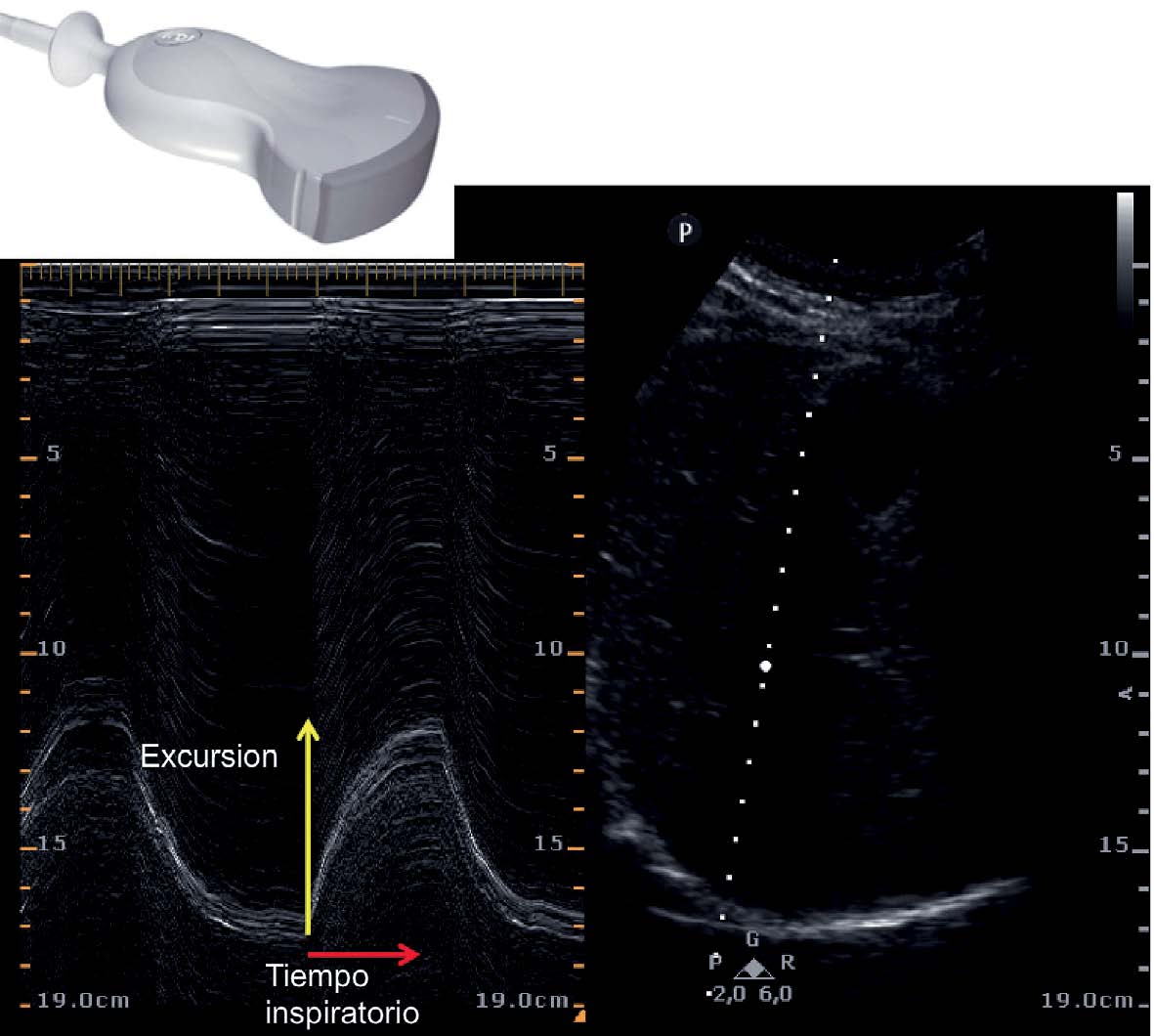
Figura 8 Estudio de la velocidad de contracción diafragmática utilizando modo M. La velocidad de contracción diafragmática esta representada por el cociente entre la Excursión inspiratoria (cm) y el Tiempo inspiratorio (seg).
1- Paresia diafragmática debida a bloqueo del plexo braquial
El bloqueo del plexo braquial, principalmente el abordaje interescalénico, se asocia a parálisis ipsilateral del hemidiafragma ipsilateral debido a la diseminación del anestésico local sobre el nervio frénico, el cual controla el movimiento diafragmático y su contracción. La incidencia de parálisis transitoria del nervio frénico es del 100% cuando se utilizan técnicas guiadas por reparos anatómicos y parestesias[ 14 ]-[ 15 ]. Dicha parálisis se encuentra limitada a la duración de acción del anestésico local y aparece cuando se utilizan volúmenes de anestésico local mayores a 10 ml[ 14 ]-[ 16 ]. Se ha reportado una incidencia del 45% de parálisis diafragmática ipsilateral con volúmenes reducidos (5 ml) utilizando técnicas ecoguiadas[ 17 ].
Si bien es posible evidenciar con US la paresia diafragmática luego de 5 minutos de administrado el anestésico local, debería repetirse la examinación a los 15 y 30 minutos luego de realizado el bloqueo para dar tiempo al desarrollo completo de la parálisis del nervio frénico[ 14 ],[ 15 ]. En presencia de paresia diafragmática la presión inspiratoria es alcanzada en gran parte por la contracción de los músculos intercostales y la expansión de la caja torácica[18]. Numerosos estudios realizados en pacientes sanos con parálisis diafragmática unilateral han reportado que la saturación de oxígeno puede permanecer sin cambios o existir una disminución menor al 7%[ 17 ],[ 19 ]-[ 20 ], probablemente debido a que la aparición de hipoxemia posee una etiología multifactorial. En contraste, existen datos que muestran que la aparición de una paresia o parálisis diafragmática podría ocasionar un fallo respiratorio agudo cuando el paciente presenta múltiples comorbilidades, recibe elevados volúmenes y/o concentración de anestésicos locales o existe disminución de la reserva contráctil en el hemidiafragma contralateral[ 21 ]-[ 23 ]. Altintas y su grupo reportaron episodios de saturación de oxígeno < 85% en el 10% en pacientes con insuficiencia renal crónica que recibieron bloqueo interescalénico con volúmenes de anestésico local de 30 ml para realización de fístula arterio-venosa[ 23 ].
El examen sonográfico del tórax permite al anestesiólogo que realiza anestesia loco-regional evaluar y realizar el diagnóstico rápido de algunas de las complicaciones asociadas a esta técnica anestésica como la aparición de disnea aguda debida a neumotórax o disfunción diafragmática, principalmente en pacientes de alto riesgo[ 24 ].
Si bien el método de referencia para el diagnóstico de parálisis bilateral es la medición de la presión transdiafragmática continua, es poco sensible para el diagnóstico de parálisis unilateral, partiendo del concepto que un hemidiafragma es suficiente para generar adecuada presión transdiafragmática durante respiración tranquila[ 5 ]. De igual manera, el US posee mayor sensibilidad que la saturación de oxígeno para evidenciar la disfunción diafragmática unilateral, debido a que ésta última evalúa la función pulmonar de manera bilateral, incluyendo el uso de los músculos accesorios y la actividad diafragmática contralateral. Al-Kaisy y su grupo estudiaron los efectos respiratorios en pacientes que recibieron bloqueo interescalénico con bajas dosis de bupivacaína, reportando que la aparición de hemiparesia diafragmática se asoció a una disminución de la capacidad vital forzada y del VEF 1 del 75 y 78%, respectivamente; sin embargo, dichos pacientes permanecieron asintomáticos sin necesidad de recibir tratamiento[ 25 ]. A pesar de existir una clara correlación entre los cambios en los test de función pulmonar y la evidencia de paresia diafragmática a través de US, aun no existen estudios que evalúen específicamente la correlación entre el US, los test de función pulmonar, la saturación de oxígeno y los síntomas subjetivos de disnea[ 26 ].
La evaluación sonográfica del diafragma presenta una elevada sensibilidad (93%) y especificidad (100%) para el diagnóstico de disfunción del nervio frénico[ 27 ], y como hemos mencionado, posee mayor agudeza diagnóstica que otros métodos portátiles como la fluoroscopía[ 5 ],[ 28 ]-[ 30 ]. Constituye la técnica de imagen de elección para el anestesiólogo, ya que permite evaluar la función diafragmática de manera dinámica, rápida, no invasiva y a la cabecera del paciente. No solo es posible realizar el diagnóstico de disfunción diafragmática sino también evaluar la recuperación realizando escaneos repetidos a través del tiempo. Cuando ocurre parálisis diafragmática ipsilateral al bloqueo interescalénico la expansión pulmonar se ve limitada y puede ocurrir ausencia de movimiento o un movimiento paradojal del hemidiafragma paralizado en dirección cefálica durante la inspiración.
Como hemos descripto anteriormente existen dos métodos para realizar el estudio sonográfico de la función diafragmática. El primero consiste en medir la excursión diafragmática durante la inspiración con una sonda convex de 3-5 MHz en modo B o M, utilizando la ventana acústica del hígado y el bazo (Vídeo 8); en ocasiones puede ser difícil de visualizar principalmente del lado izquierdo y puede demandar tiempo su estudio (Figura 9 y 10). El segundo, consiste en evaluar la FED a nivel de la zona de aposición del diafragma en la caja torácica utilizando una sonda lineal de alta frecuencia[ 5 ],[ 9 ],[ 29 ], esta metodología de evaluación es más rápida y utiliza la misma sonda con que se realizó el bloqueo regional (Figura 11). Sin embargo, aún no se han reportado datos que comparen cuál de estos dos métodos es mas efectivo[ 31 ].
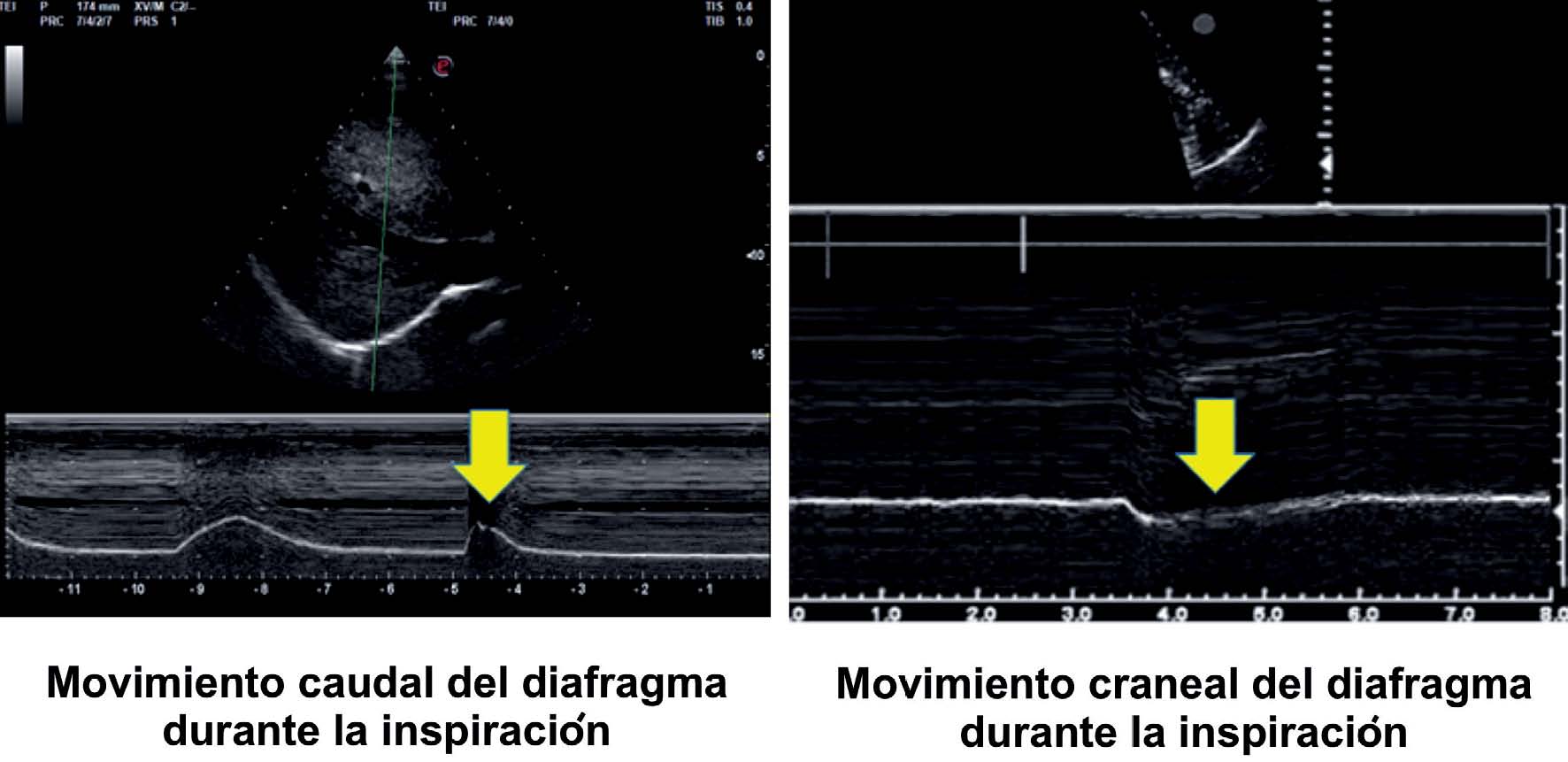
Figura 9 Evaluación de la excursión diafragmática con sonda sectorial 2-5 MHz, utilizando el abordaje subcostal anterior. A la izquierda se observa hemidiafragma derecho en modo M, con movimiento caudal del hemidiafragma hacia el transductor durante la maniobra de sniffing. A la derecha se evidencia parálisis diafragmática luego de realizar un bloqueo interescalénico, que genera un movimiento paradojal durante la maniobra de sniffing.
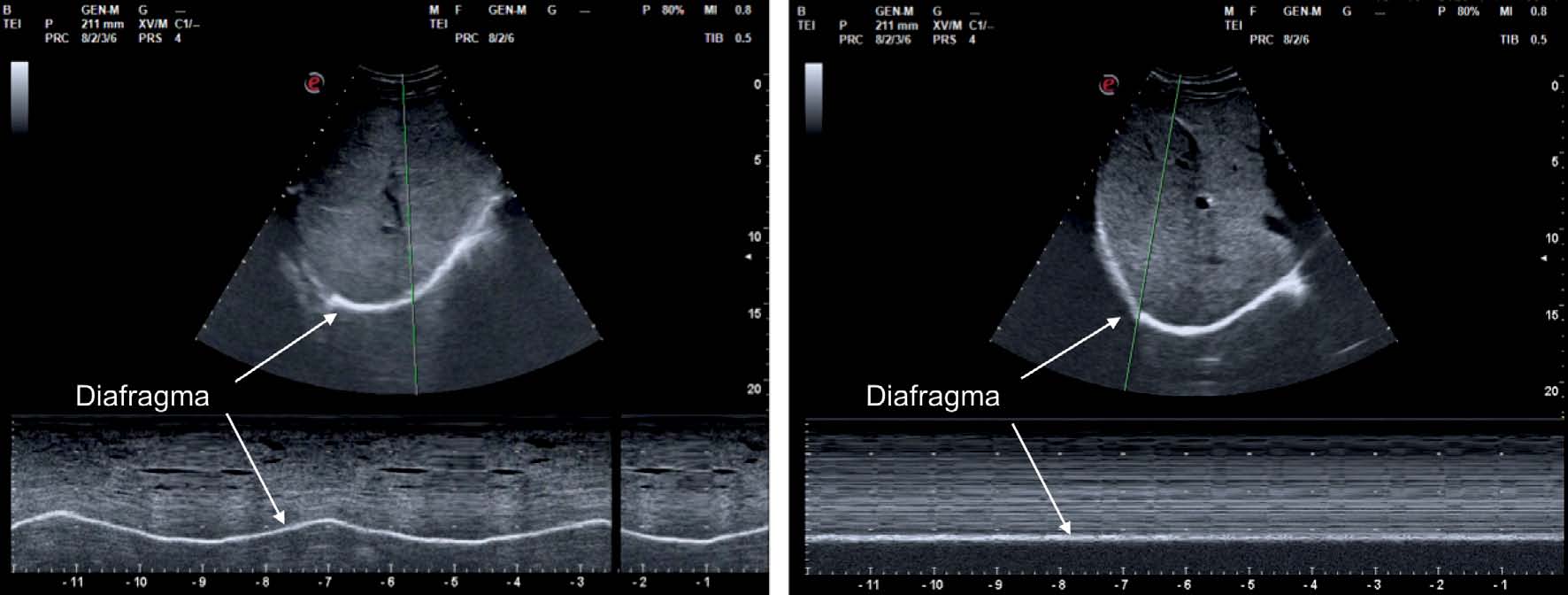
Figura 10 Evaluación de la excursión del hemidiafragma derecho con sonda convex 2-6 MHz. A la izquierda se observa movimiento caudal del hemidiafragma derecho, hacia el transductor en modo M. A la derecha se evidencia ausencia de movimiento del hemidiafragma derecho, hacia el transductor en modo M. A la derecha se evidencia ausencia de movimiento del hemidiafragma debida a parálisis diafragmática.
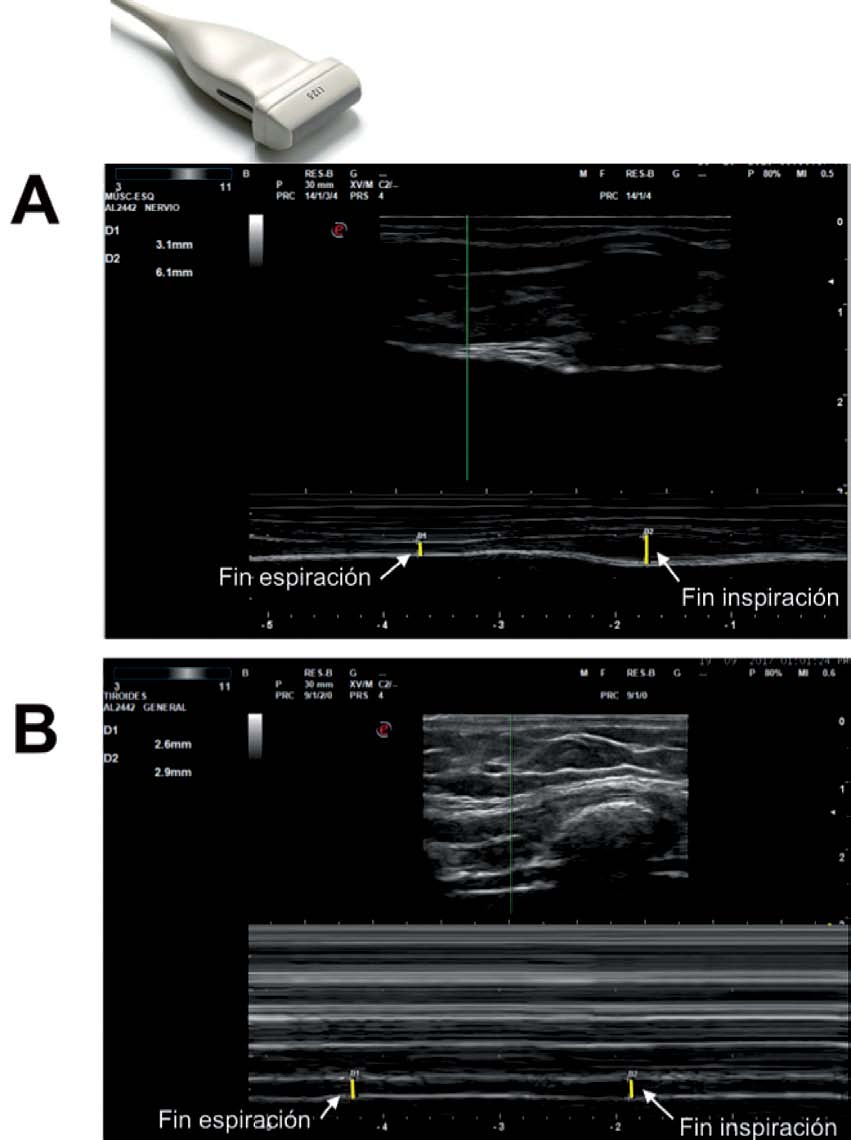
Figura 11 Medición de la fracción de engrosamiento utilizando sonda lineal 6-13 MHz a nivel de la zona de aposición, en modo B. Arriba se observa un paciente con reserva contráctil conservada, engrosamiento del hemidiafragma al fin de la inspiración y disminución del mismo al fin de espiración. Abajo deterioro en la fracción de engrosamiento debida a paresia diafragmática.
2- Disfunción diafragmática en el paciente post-quirúrgico
La disfunción diafragmática constituye uno de los factores determinantes en la patogénesis de las complicaciones pulmonares post-operatorias asociada a cirugías de tórax y abdomen superior. El deterioro en la reserva contráctil del diafragma puede prolongar la necesidad de asistencia ventilatoria mecánica y a la vez retrasar o conducir al fracaso del periodo de weaning.
Kim y colaboradores estudiaron en pacientes programados para hepatectomía la amplitud de excursión diafragmática utilizando modo M durante el pre y post-operatorio. Los autores encontraron durante el postoperatorio una correlación lineal entre la amplitud inspiratoria diafragmática y la capacidad vital medida a través de espirometría. El valor de corte más adecuado de amplitud diafragmática inspiratoria que detecta el 30 y 50% de disminución de la capacidad vital en el post-operatorio fue de 36 mm y 24 mm respectivamente. La sensibilidad y especificidad para detectar con ultrasonido una disminución del 30% de la capacidad vital fue de 94 y 76%, y del 81% y 91% para evidenciar una disminución del 50%[ 32 ].
En pacientes sometidos a colecistectomía tanto por vía videolaparoscópica como convencional el examen sonográfico del diafragma en modo M durante el post-operatorio puede mostrar una disminución en la excursión inspiratoria durante la respiración normal y profunda[ 31 ]. Existe evidencia que sugiere que el deterioro diafragmático luego de una cirugía abdominal superior se puede explicar por la inhibición refleja de la actividad eferente del nervio frénico debido a la irritación de las aferencias esplácnicas, mas que por fallo contráctil o trauma quirúrgico de la pared abdominal[ 34 ],[ 35 ].
La injuria del nervio frénico puede ocurrir en el post-operatorio de cirugía cardiaca generando paresia o parálisis del hemidiafragma ipsilateral. Lerolle y su grupo estudiaron la excursión diafragmática bilateral en esta población de pacientes, identificando como parámetro funcional de performance diafragmática la excursión máxima, reportando que aquellos pacientes con parálisis diafragmática unilateral que presentaban una excursión máxima del hemidiafragma contralateral > 25 mm tuvieron un periodo de weaning exitoso sin prolongar el periodo de ventilación mecánica. Sin embargo, una excursión máxima < 25 mm fue indicativa de paresia o parálisis diafragmática bilateral. Dicha disfunción diafragmática severa se asocio a mayor tiempo de requerimiento de ventilación mecánica y estadía en cuidados intensivos[ 36 ]. Este estudio evidencia la necesidad de examinar ambos hemidiafragmas en el post-operatorio de cirugía cardiaca debido a que estos pacientes se encuentran expuestos a la injuria del nervio frénico. En ocasiones durante el post-operatorio de cirugía cardiaca suele ser dificultoso examinar el diafragma utilizando la ventana subcostal debido a la mala ventana acústica o la presencia de apósitos; por lo que una alternativa es posicionar el transductor a nivel de la línea axilar media.
3- Evaluación de la función diafragmática en el paciente crítico
La evaluación del engrosamiento diafragmático a nivel intercostal en la “zona de aposición”, constituye el mejor abordaje para evaluar la disfunción y atrofia diafragmática en el paciente en ventilación mecánica, ya sea de manera asistida o controlada. Los valores normales de engrosamiento a nivel de la capacidad residual funcional son 1,8 a 3 mm. El engrosamiento diafragmático se incrementa en forma lineal hasta un 54% a medida que el volumen pulmonar aumenta desde el volumen residual a la capacidad pulmonar total[ 37 ]. Goligher y su grupo en un estudio multicéntrico, reportaron que en los primeros 8 días de ventilación mecánica el 44% de los pacientes presentaron una disminución del 10% en el engrosamiento diafragmático. En este grupo de pacientes se observo además una baja contractilidad diafragmática y un elevado “driving pressure” en los parámetros respiratorios. Los autores concluyen que la presión soporte debe ser titulada para mantener y estimular la contractilidad diafragmática evaluada a través de US[ 38 ]. De igual manera, Kim y su grupo demostraron que un 29% de los pacientes en ventilación mecánica, sin patología diafragmática previa, presentaron disfunción diafragmática, la cual se asocio a un mayor requerimiento de asistencia ventilatoria, tiempos de weaning mas prolongados y fracaso en el weaning comparado con aquellos pacientes que no presentaron disfunción diafragmática[ 39 ].
Matamis y su grupo han reportado el rol de la evaluación sonográfica del diafragma durante la ventilación asistida. Como lo hemos mencionado previamente, es importante destacar que cuando el paciente se encuentra en una modalidad asistida existen dos fuerzas: una fuerza activa que es la contracción muscular propia del paciente y otra es el desplazamiento pasivo generado por la presión positiva externa. De tal manera que no es posible distinguir que fuerza corresponde a cada componente. Por consiguiente, si queremos evaluar la excursión diafragmática en un paciente bajo asistencia mecánica es necesario desvincularlo transitoriamente del respirador. A través de un registro en modo M de la excursión diafragmática y la curva de presión en via aérea es posible optimizar la sincronización entre el esfuerzo del paciente durante la ventilación asistida y el respirador[ 5 ].
4- Disfunción diafragmática durante el weaning de la ventilación mecánica
Numerosos estudios han destacado el rol de la evaluación sonográfica del diafragma en el proceso de weaning. Kim y colaboradores estudiaron la excursión diafragmática utilizando modo M durante el proceso de weaning, estableciendo como parámetro de disfunción diafragmática una excursión < 10 mm o un movimiento paradojal, para cualquiera de ambos hemidiafragmas. Reportaron una prevalencia de disfunción diafragmática del 29%. Dicha disfunción se asocio con periodos mas prolongados de weaning, mayor incidencia de reintubación y requerimiento de ventilación mecánica[ 39 ]. De esta manera el US permite identificar pacientes con riesgo de weaning dificultoso.
Mariani y su grupo estudiaron la excursión diafragmática en pacientes deterioro en la cinética de ambos hemidiafragmas asociado a ventilación mecánica prolongada, dichos pacientes presentaron una excursión inspiratoria < 11 mm y evidenciaron una mejoría progresiva en la excursión en el 71% de los pacientes[ 40 ]. El examen sonográfico del diafragma no solo permite realizar el diagnostico de disfunción diafragmática sino también posee un rol clave en la monitorizar su recuperación.
Ferrari y colaboradores estudio el índice predictivo de weaning después de una prueba de ventilación espontanea, reportando que una FED ≥ 36% se asocio a un weaning exitoso con una sensibilidad del 82% y una especificidad del 88%, un valor predictivo positivo de 92% y un valor predictivo negativo de 75% para el éxito o falla de la discontinuación de la ventilación mecánica a las 48 horas[41]. Este grupo realizo la evaluación de la FED a nivel de la zona de aposición, posicionando el transductor lineal a nivel del 8-9° espacio intercostal entre la línea axilar anterior y media; realizando dos mediciones: a capacidad pulmonar total y luego a volumen residual. Utilizaron modo B debido a que esta técnica aporta mayor definición anatómica del musculo y sus estructuras adyacentes junto con una visión más panorámica en comparación al modo M[ 41 ]. Di Nino realizo un estudio similar en 63 pacientes, reportando que una FED ≥ 30% se asocio con un valor predictivo positivo de 91% y un valor predictivo negativo de 63% para un weaning exitoso[ 42 ].
En la Tabla 2 se describen las principales mediciones utilizadas en el paciente bajo soporte ventilatorio durante la ventilación mecánica.
5- Función diafragmática en el paciente EPOC
Numerosos estudios han demostrado la utilidad del US en el estudio del diafragma en el paciente EPOC. Zanforlin y su grupo describieron un índice que podría indirectamente detectar un patrón obstructivo de la vía aérea a través del cálculo del índice de obstrucción en modo M (IOM). Estableciendo un valor de corte para sospecha de patrón espirométrico obstructivo < 77 con un valor predictivo positivo de 95,5%[ 43 ]. El IOM representa la velocidad de relajación diafragmática y se calcula (Figura 12):
IOM % = (Excursión diafragmática espiratoria forzada en el 1° Segundo) / (Excursión diafragmática espiratoria máxima)
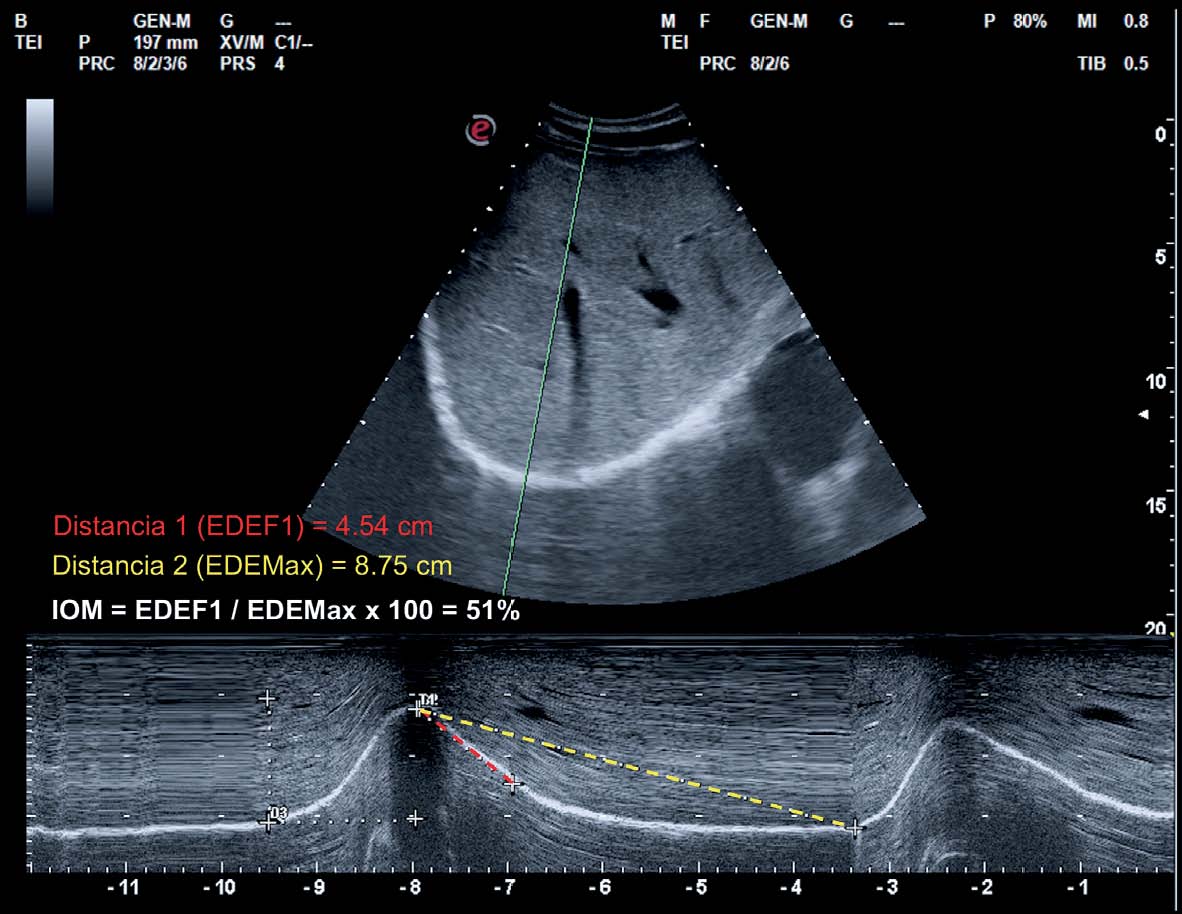
Figura 12 Cálculo del índice de obstrucción en modo M (IOM) durante una espiración forzada en un paciente EPOC. IOM = Excursión Diafragmática Espiratoria máxima [EDEmáx] / Excursión Diafragmática Espiratoria Forzada del 1° segundo [FEDE1]) = 51%.
Este índice podría ser una alternativa a la evaluación de la curva volumen/tiempo obtenida por espirometría, considerada técnica de elección, la cual analiza la relación entre el volumen espiratorio forzado del 1° segundo (FEV 1 ) y la capacidad pulmonar.
Dentro de las limitaciones de esta técnica encontramos la mala ventana acústica, especialmente en pacientes obesos, heridas que impidan el adecuado posicionamiento de la sonda o la presencia de enfisema subcutáneo.
En resumen, podemos decir que el examen sonográfico del diafragma constituye una nueva herramienta para el anestesiólogo, permite evaluar la función diafragmática del paciente quirúrgico durante el peri-operatorio de manera dinámica, no invasiva y a la cabecera del paciente.
El US del diafragma, constituye un método reproducible y con poca variabilidad inter-observador, puede ser repetido a lo largo del tiempo permitiendo una monitorización dinámica de la recuperación de la fuerza contráctil en el paciente con disfunción diafragmática. Probablemente la evaluación sonográfica del engrosamiento diafragmático a nivel de la zona de aposición utilizando la sonda lineal constituye el abordaje mas atractivo para los anestesiólogos a la hora de evaluar una disfunción durante el peri-operatorio, debido a que técnicamente es más rápido y simple de realizar, requiere la misma sonda que utilizamos para abordar los bloqueos loco-regionales o punciones vasculares ecoguiadas.
La evaluación sonográfica peri-operatoria del diafragma debería ser utilizada de manera integrada al examen sonográfico del pulmón ante un paciente con fallo respiratorio agudo, permitiendo de esta manera el diagnostico de patologías pulmonares como derrame pleural o consolidaciones que pueden generar una disfunción diafragmática como así también evidenciar disfunciones previas. De esta manera podemos optimizar nuestra estrategia anestésica en pacientes críticos con riesgo a presentar complicaciones respiratorias en el post-operatorio.
Son necesarios estudios que evalúen el rol y limitaciones en la monitorización del paciente critico.
Referencias
1. Al-Bilbeisi F, McCOOL FD. Diaphragm recruitment during nonrespiratory activities. Am J Respir Crit Care Med. 2000 Aug;162(2 Pt 1):456–9. https://doi.org/10.1164/ajrccm.162.2.9908059 PMID:10934070
2. Loring SH, Mead J. Action of the diaphragm on the rib cage inferred from a force-balance analysis. J Appl Physiol. 1982 Sep;53(3):756–60. https://doi.org/10.1152/jappl.1982.53.3.756 PMID:6215388
3. Haber K, Asher M, Freimanis AK. Echographic evaluation of diaphragmatic motion in intra-abdominal diseases. Radiology. 1975 Jan;114(1):141–4. https://doi.org/10.1148/114.1.141 PMID:1208854
4. Boussuges A, Gole Y, Blanc P. Diaphragmatic motion studied by m-mode ultrasonography: methods, reproducibility, and normal values. Chest. 2009 Feb;135(2):391–400. https://doi.org/10.1378/chest.08-1541 PMID:19017880
5. Matamis D, Soilemezi E, Tsagourias M, Akoumianaki E, Dimassi S, Boroli F, et al. Sonographic evaluation of the diaphragm in critically ill patients. Technique and clinical applications. Intensive Care Med. 2013 May;39(5):801–10. https://doi.org/10.1007/s00134-013-2823-1 PMID:23344830
6. Gerscovich EO, Cronan M, McGahan JP, Jain K, Jones CD, McDonald C. Ultrasonographic evaluation of diaphragmatic motion. J Ultrasound Med. 2001 Jun;20(6):597–604. https://doi.org/10.7863/jum.2001.20.6.597 PMID:11400933
7. Lloyd T, Tang YM, Benson MD, King S. Diaphragmatic paralysis: the use of M mode ultrasound for diagnosis in adults. Spinal Cord. 2006 Aug;44(8):505–8. https://doi.org/10.1038/sj.sc.3101889 PMID:16331304
8. Alexander C. Diaphragm movements and the diagnosis of diaphragmatic paralysis. Clin Radiol. 1966 Jan;17(1):79–83. https://doi.org/10.1016/S0009-9260(66)80128-9 PMID:4221861
9. Tsui JJ, Tsui BC. A novel systematic ABC approach to Diaphragmatic Evaluation (ABCDE). Can J Anaesth. 2016 May;63(5):636–7. https://doi.org/10.1007/s12630-015-0566-x PMID:26684458
10. Tsui BC, Tsui J. ABC diaphragmatic evaluation for neonates. Paediatr Anaesth. 2016 Jul;26(7):768–9. https://doi.org/10.1111/pan.12914 PMID:27277652
11. Jiang JR, Tsai TH, Jerng JS, Yu CJ, Wu HD, Yang PC. Ultrasonographic evaluation of liver/spleen movements and extubation outcome. Chest. 2004 Jul;126(1):179–85. https://doi.org/10.1016/S0012-3692(15)32912-3 PMID:15249460
12. Goligher EC, Laghi F, Detsky ME, Farias P, Murray A, Brace D, et al. Measuring diaphragm thickness with ultrasound in mechanically ventilated patients: feasibility, reproducibility and validity. Intensive Care Med. 2015 Apr;41(4):642–9. https://doi.org/10.1007/s00134-015-3687-3 PMID:25693448
13. Umbrello M, Formenti P, Longhi D, Galimberti A, Piva I, Pezzi A, et al. Diaphragm ultrasound as indicator of respiratory effort in critically ill patients undergoing assisted mechanical ventilation: a pilot clinical study. Crit Care. 2015 Apr;19(1):161. https://doi.org/10.1186/s13054-015-0894-9 PMID:25886857
14. Urmey WF, Talts KH, Sharrock NE. One hundred percent incidence of hemidiaphragmatic paresis associated with interscalene brachial plexus anesthesia as diagnosed by ultrasonography. Anesth Analg. 1991 Apr;72(4):498–503. https://doi.org/10.1213/00000539-199104000-00014 PMID:2006740
15. Urmey WF, Gloeggler PJ. Pulmonary function changes during interscalene brachial plexus block: effects of decreasing local anesthetic injection volume. Reg Anesth. 1993 Jul-Aug;18(4):244–9. PMID:8398959
16. Sala-Blanch X, Lázaro JR, Correa J, Gómez-Fernandez M. Phrenic nerve block caused by interscalene brachial plexus block: effects of digital pressure and a low volume of local anesthetic. Reg Anesth Pain Med. 1999 May-Jun;24(3):231–5. https://doi.org/10.1097/00115550-199924030-00009 PMID:10338173
17. Riazi S, Carmichael N, Awad I, Holtby RM, McCartney CJ. Effect of local anaesthetic volume (20 vs 5 ml) on the efficacy and respiratory consequences of ultrasound-guided interscalene brachial plexus block. Br J Anaesth. 2008 Oct;101(4):549–56. https://doi.org/10.1093/bja/aen229 PMID:18682410
18. Fujimura N, Namba H, Tsunoda K, Kawamata T, Taki K, Igarasi M, et al. Effect of hemidiaphragmatic paresis caused by interscalene brachial plexus block on breathing pattern, chest wall mechanics, and arterial blood gases. Anesth Analg. 1995 Nov;81(5):962–6. PMID:7486085
19. Wong AK, Keeney LG, Chen L, Williams R, Liu J, Elkassabany NM. Effect of local anesthetic concentration (0.2% vs 0.1% ropivacaine) on pulmonary function, and analgesia after ultrasound-guided interscalene brachial plexus block: A randomized controlled study. Pain Med. 2016 Dec;17(12):2397–403. https://doi.org/10.1093/pm/pnw057 PMID:28025374
20. Thackeray EM, Swenson JD, Gertsch MC, Phillips KM, Steele JW, Burks RT, et al. Diaphragm function after interscalene brachial plexus block: a double-blind, randomized comparison of 0.25% and 0.125% bupivacaine. J Shoulder Elbow Surg. 2013 Mar;22(3):381–6. https://doi.org/10.1016/j.jse.2012.06.011 PMID:22947235
21. Pere P, Pitkänen M, Rosenberg PH, Björkenheim JM, Linden H, Salorinne Y, et al. Effect of continuous interscalene brachial plexus block on diaphragm motion and on ventilatory function. Acta Anaesthesiol Scand. 1992 Jan;36(1):53–7. https://doi.org/10.1111/j.1399-6576.1992.tb03421.x PMID:1539480
22. Smith MP, Tetzlaff JE, Brems JJ. Asymptomatic profound oxyhemoglobin desaturation following interscalene block in a geriatric patient. Reg Anesth Pain Med. 1998 Mar-Apr;23(2):210–3. https://doi.org/10.1097/00115550-199823020-00017 PMID:9570613
23. Altintas F, Gumus F, Kaya G, Mihmanli I, Kantarci F, Kaynak K, et al. Interscalene brachial plexus block with bupivacaine and ropivacaine in patients with chronic renal failure: diaphragmatic excursion and pulmonary function changes. Anesth Analg. 2005 Apr;100(4):1166–71. https://doi.org/10.1213/01.ANE.0000154443.68396.70 PMID:15781539
24. Haskins SC, Tsui BC, Nejim JA, Wu CL, Boublik J. Ultrasound for the regional anesthesiologist and acute pain specialist. Reg Anesth Pain Med. 2017 May/Jun;42(3):289–98. https://doi.org/10.1097/AAP.0000000000000583 PMID:28282364
25. al-Kaisy AA, Chan VW, Perlas A. Respiratory effects of low-dose bupivacaine interscalene block. Br J Anaesth. 1999 Feb;82(2):217–20. https://doi.org/10.1093/bja/82.2.217 PMID:10364997
26. El-Boghdadly K, Chin KJ, Chan VW. Phrenic nerve palsy and regional anesthesia for shoulder surgery. Anesthesiology. 2017 Jul;127(1):173–91. https://doi.org/10.1097/ALN.0000000000001668 PMID:28514241
27. Boon AJ, Sekiguchi H, Harper CJ, Strommen JA, Ghahfarokhi LS, Watson JC, et al. Sensitivity and specificity of diagnostic ultrasound in the diagnosis of phrenic neuropathy. Neurology. 2014 Sep;83(14):1264–70. https://doi.org/10.1212/WNL.0000000000000841 PMID:25165390
28. Houston JG, Fleet M, Cowan MD, McMillan NC. Comparison of ultrasound with fluoroscopy in the assessment of suspected hemidiaphragmatic movement abnormality. Clin Radiol. 1995 Feb;50(2):95–8. https://doi.org/10.1016/S0009-9260(05)82987-3 PMID:7867276
29. Testa A, Soldati G, Giannuzzi R, Berardi S, Portale G, Gentiloni Silveri N. Ultrasound M-mode assessment of diaphragmatic kinetics by anterior transverse scanning in healthy subjects. Ultrasound Med Biol. 2011 Jan;37(1):44–52. https://doi.org/10.1016/j.ultrasmedbio.2010.10.004 PMID:21144957
30. Zambon M, Cabrini L, Beccaria P, Zangrillo A, Colombo S. Ultrasound in critically ill patients: focus on diaphragm. Intensive Care Med. 2013 May;39(5):986. https://doi.org/10.1007/s00134-013-2882-3 PMID:23503895
31. Zambon M, Greco M, Bocchino S, Cabrini L, Beccaria PF, Zangrillo A. Assessment of diaphragmatic dysfunction in the critically ill patient with ultrasound: a systematic review. Intensive Care Med. 2017 Jan;43(1):29–38. https://doi.org/10.1007/s00134-016-4524-z PMID:27620292
32. Kim SH, Na S, Choi JS, Na SH, Shin S, Koh SO. An evaluation of diaphragmatic movement by M-mode sonography as a predictor of pulmonary dysfunction after upper abdominal surgery. Anesth Analg. 2010 May;110(5):1349–54. https://doi.org/10.1213/ANE.0b013e3181d5e4d8 PMID:20418298
33. Ayoub J, Cohendy R, Prioux J, Ahmaidi S, Bourgeois JM, Dauzat M, et al. Diaphragm movement before and after cholecystectomy: a sonographic study. Anesth Analg. 2001 Mar;92(3):755–61. https://doi.org/10.1213/00000539-200103000-00038 PMID:11226114
34. Ford GT, Whitelaw WA, Rosenal TW, Cruse PJ, Guenter CA. Diaphragm function after upper abdominal surgery in humans. Am Rev Respir Dis. 1983 Apr;127(4):431–6. https://doi.org/10.1164/arrd.1983.127.4.431 PMID:6838049
35. Dureuil B, Viirès N, Cantineau JP, Aubier M, Desmonts JM. Diaphragmatic contractility after upper abdominal surgery. J Appl Physiol (1985). 1986 Nov;61(5):1775–80. https://doi.org/10.1152/jappl.1986.61.5.1775 PMID:3781987
36. Lerolle N, Guérot E, Dimassi S, Zegdi R, Faisy C, Fagon JY, et al. Ultrasonographic diagnostic criterion for severe diaphragmatic dysfunction after cardiac surgery. Chest. 2009 Feb;135(2):401–7. https://doi.org/10.1378/chest.08-1531 PMID:18753469
37. Cohn D, Benditt JO, Eveloff S, McCool FD. Diaphragm thickening during inspiration. J Appl Physiol (1985). 1997 Jul;83(1):291–6. https://doi.org/10.1152/jappl.1997.83.1.291 PMID:9216975
38. Goligher EC, Fan E, Herridge MS, Murray A, Vorona S, Brace D, et al. Evolution of diaphragm thickness during mechanical ventilation. Impact of inspiratory effort. Am J Respir Crit Care Med. 2015 Nov;192(9):1080–8. https://doi.org/10.1164/rccm.201503-0620OC PMID:26167730
39. Kim WY, Suh HJ, Hong SB, Koh Y, Lim CM. Diaphragm dysfunction assessed by ultrasonography: influence on weaning from mechanical ventilation. Crit Care Med. 2011 Dec;39(12):2627–30. https://doi.org/10.1097/CCM.0b013e3182266408 PMID:21705883
40. Mariani LF, Bedel J, Gros A, Lerolle N, Milojevic K, Laurent V, et al. Ultrasonography for screening and follow-up of diaphragmatic dysfunction in the ICU: a pilot study. J Intensive Care Med. 2016 Jun;31(5):338–43. https://doi.org/10.1177/0885066615583639 PMID:25979406
41. Ferrari G, De Filippi G, Elia F, Panero F, Volpicelli G, Aprà F. Diaphragm ultrasound as a new index of discontinuation from mechanical ventilation. Crit Ultrasound J. 2014 Jun;6(1):8. https://doi.org/10.1186/2036-7902-6-8 PMID:24949192
42. DiNino E, Gartman EJ, Sethi JM, McCool FD. Diaphragm ultrasound as a predictor of successful extubation from mechanical ventilation. Thorax. 2014 May;69(5):423–7. https://doi.org/10.1136/thoraxjnl-2013-204111 PMID:24365607
43. Zanforlin A, Smargiassi A, Inchingolo R, di Marco Berardino A, Valente S, Ramazzina E. Ultrasound analysis of diaphragm kinetics and the diagnosis of airway obstruction: the role of the M-mode index of obstruction. Ultrasound Med Biol. 2014 Jun;40(6):1065–71. https://doi.org/10.1016/j.ultrasmedbio.2013.12.009 PMID:24486237
Diafragmatic Ultrasound, a new tool for the anesthesiologistDiafragmatic Ultrasound, a new tool for the anesthesiologist

- cuidados intensivos
- disfunción diafragmática
- ultrasonido
Related Articles
Agonistas Glucagon Like Peptide – 1 (GLP-1) y retraso del vaciamiento gástrico: Consideraciones anestésicas y clínicas

Anestesia en paciente oncológico
Analgesia multimodal en un paciente con cáncer de páncreas metastásico en el departamento de emergencia.

Privacy Overview
REPUBLISHING TERMS
You may republish this article online or in print under our Creative Commons license. You may not edit or shorten the text, you must attribute the article to Revista Chilena de Anestesia and you must include the author’s name in your republication.
If you have any questions, please email [email protected]
Qué ver en Elektrostal - Las 10 mejores cosas qué hacer en Elektrostal, Rusia
Cosas que hacer en elektrostal.
- 5,0 de 5 burbujas
- 4,0 de 5 burbujas y superior
- Entrada gratuita
- Ideal para días lluviosos
- Apto para niños
- Recomendado para grupos grandes
- Joyas ocultas
- Recomendado para parejas
- Lugar para luna de miel
- Recomendado para los adictos a la adrenalina
- Las cosas que hacer clasificadas a partir de datos de Tripadvisor, como las opiniones, las puntuaciones, las fotos y el índice de popularidad.

1. Electrostal History and Art Museum

2. Statue of Lenin

3. Park of Culture and Leisure
4. museum and exhibition center.

5. Museum of Labor Glory

7. Galereya Kino
8. viki cinema, 9. smokygrove.

10. Gandikap
11. papa lounge bar, 12. karaoke bar.
Things to Do in Elektrostal, Russia - Elektrostal Attractions
Things to do in elektrostal.
- 5.0 of 5 bubbles
- 4.0 of 5 bubbles & up
- Good for a Rainy Day
- Good for Kids
- Good for Big Groups
- Adventurous
- Budget-friendly
- Hidden Gems
- Good for Couples
- Honeymoon spot
- Good for Adrenaline Seekers
- Things to do ranked using Tripadvisor data including reviews, ratings, photos, and popularity.

1. Electrostal History and Art Museum

2. Statue of Lenin

3. Park of Culture and Leisure
4. museum and exhibition center.

5. Museum of Labor Glory

7. Galereya Kino
8. viki cinema, 9. smokygrove.

10. Gandikap
11. papa lounge bar, 12. karaoke bar.

- Bahasa Indonesia
- Eastern Europe
- Moscow Oblast
Elektrostal
Elektrostal Localisation : Country Russia , Oblast Moscow Oblast . Available Information : Geographical coordinates , Population, Area, Altitude, Weather and Hotel . Nearby cities and villages : Noginsk , Pavlovsky Posad and Staraya Kupavna .
Information
Find all the information of Elektrostal or click on the section of your choice in the left menu.
- Update data
Elektrostal Demography
Information on the people and the population of Elektrostal.
Elektrostal Geography
Geographic Information regarding City of Elektrostal .
Elektrostal Distance
Distance (in kilometers) between Elektrostal and the biggest cities of Russia.
Elektrostal Map
Locate simply the city of Elektrostal through the card, map and satellite image of the city.
Elektrostal Nearby cities and villages
Elektrostal weather.
Weather forecast for the next coming days and current time of Elektrostal.
Elektrostal Sunrise and sunset
Find below the times of sunrise and sunset calculated 7 days to Elektrostal.
Elektrostal Hotel
Our team has selected for you a list of hotel in Elektrostal classified by value for money. Book your hotel room at the best price.
Elektrostal Nearby
Below is a list of activities and point of interest in Elektrostal and its surroundings.
Elektrostal Page

- Information /Russian-Federation--Moscow-Oblast--Elektrostal#info
- Demography /Russian-Federation--Moscow-Oblast--Elektrostal#demo
- Geography /Russian-Federation--Moscow-Oblast--Elektrostal#geo
- Distance /Russian-Federation--Moscow-Oblast--Elektrostal#dist1
- Map /Russian-Federation--Moscow-Oblast--Elektrostal#map
- Nearby cities and villages /Russian-Federation--Moscow-Oblast--Elektrostal#dist2
- Weather /Russian-Federation--Moscow-Oblast--Elektrostal#weather
- Sunrise and sunset /Russian-Federation--Moscow-Oblast--Elektrostal#sun
- Hotel /Russian-Federation--Moscow-Oblast--Elektrostal#hotel
- Nearby /Russian-Federation--Moscow-Oblast--Elektrostal#around
- Page /Russian-Federation--Moscow-Oblast--Elektrostal#page
- Terms of Use
- Copyright © 2024 DB-City - All rights reserved
- Change Ad Consent Do not sell my data

IMAGES
VIDEO
COMMENTS
El diafragma es el principal músculo respiratorio. Caracterizado por tener una forma abovedada, consta de una parte fibrosa central (sirve básicamente como anclaje) y otra periférica, muscular, cuya contracción genera el típico movimiento cráneo-caudal diafragmático. . Causa de lesión diafragmática.
Es por esto que la ultrasonografía diafragmática como herramienta a la cabecera del paciente ha demostrado ser de gran utilidad. En nuestro estudio, se documentó disfunción diafragmática únicamente en el 1,2% de los casos a diferencia de las series reportadas en la literatura, donde la prevalencia se encuentra en el 23-36% 12 .
La excursión diafragmática se puede evaluar en la vista anterior, posterior o subxifoidea, en individuos sanos se ha reportado como valor medio de 4.7 a 1.8 ± 0.3 cm para hombres y para mujeres de 3.7 a 1.6 ± 0.3 cm;12 los valores de excursión se identifi caron por Kim y colaboradores (> 1.8 cm) en pacientes ven-
La ecografía diafragmática es una técnica cuyo desarrollo en la Neumología moderna la llevará a ser otra herramienta más en el arsenal diagnóstico del neumólogo. Su rápida implantación también obedece a la facilidad para obtener experiencia en su uso, con una rápida curva de aprendizaje 15.
The mean diaphragmatic thickness measured during expiration was 3.4 mm, while in inspiration it was 2.58 mm; with a thickening fraction of approximately 43 %. The mean diaphragmatic excursion measured in M-mode was 15 mm and maximum 21 mm, and was the only variable with normal distribution under the Gaussian bell (Figure 2).
A ventilação mecânica invasiva (VMI) é uma terapia de suporte de vida que não apresenta complicações, como disfunção diafragmática induzida por ventilação mecânica, caracterizada por atrofia e fraqueza do referido músculo. O interesse por essa patologia parece basear-se na associação encontrada com resultados clínicos negativos.
La ecografía ofrece por su parte una técnica incruenta, sin radiación, realizable a pie de cama, repetible cuantas veces sea necesario y que permite medir la excursión diafragmática (destinada a diagnosticar disfunciones), medir el engrosamiento diafragmático durante el ciclo respiratorio en la zona de aposición costal (que representa la ...
Varios son los trabajos que relacionan valores mayores de excursión diafragmática con destete exitoso de la ventilación mecánica 56, 57, 58. Función pulmonar La acumulación de líquido pleural da como resultado una atelectasia del pulmón adyacente (asociado con la presión hidrostática generada por el derrame).
Se realiza en decúbito supino, a 15° aproximadamente, y en espiración se toma en cuenta el diámetro mayor en el espacio interpleural en milímetros. Este valor obtenido se multiplica por 20 y obtenemos la cantidad de mililitros aproximados. Esta fórmula se encuentra validada en VM. Ecografía diafragmática.
Evaluar la excursión diafragmática (ED) como predictor de éxito para . el retiro de la VMI en pacientes obesos. Material y métodos: Se realizó un estudio transversal, prospectivo, compa - rativo y analítico, en pacientes obesos ingresados a las UCI con VMI por más de 48 horas. Se analizaron variables demográficas, índice de ventilación de
La ecografía ha surgido como una técnica no invasiva que se puede utilizar en la evaluación estructural y funcional del diafragma. Los ultrasonidos permiten observar el movimiento diafragmático en una variedad de condiciones normales y patológicas. Exponemos cuatro casos clínicos en los que la evaluación de la disfunción diafragmática por ecografía permitió hacer un diagnóstico del ...
Realizamos subanálisis según: 1) el diafragma evaluado mediante ecografía (uni- o bilateral); y 2) la definición ecográfica de disfunción diafragmática, es decir, excursión diafragmática (ED) versus otras: fracción de engrosamiento diafragmático (FEG), tiempo hasta la amplitud del pico inspiratorio del diafragma (TAPI dia ...
Existió una correlación positiva significativa (r = 0,475; p = 0,009) entre la FVC y la diferencia de la excursión por sniff nasal pero no se encontró esta correlación con las medidas de excursión diafragmática medidas con las otras 2 maniobras. Relación entre la disnea y la excursión diafragmática
mática por ultrasonido en modo M en 88 unidades de terapia intensiva; encontró una prevalencia de 29% (por excursión diafragmática < 1 cm o movimientos pa-radójicos del diafragma). Los individuos con disfunción diafragmática tuvieron un incremento en el número de intentos de retiro de la VM y en los días de ventilación mecánica.
La valoración de la excursión diafragmática y la fracción de engrosamiento diafragmático proporcionó una escala predictiva valiosa, para prever que pacientes tendrán una extubación exitosa ...
Hallazgos Monitorización de la máxima excursión diafragmática por inspiración en Modo M. Valoración del grosor diafragmático en inspiración y expiración. Cálculo índice de grosor diafragmático Vázquez JL., Coca A., Sánchez M., Protocolo de ecografía de la función diafragmática. 2020.
Excursión diafragmática (ED): Se utilizó una sonda convex. ... Henriquez C. Utilidad de la Ecografía Clínica en neumonía vírica por coronavirus. Evidencias en Ecografía Clínica. Especial. 2020 Apr;COVID19:4-11. 12. Huang Y, Wang S, Liu Y, Zhang Y, Zheng C, Zheng Y, et al. A Preliminary Study on the Ultrasonic Manifestations of Peri ...
Asociación Española de Pediatría | Asociación Española de Pediatría
A- Evaluación de la excursión diafragmática. Para estudiar la excursión diafragmática utilizaremos una sonda convex 2-6 MHz o sectorial 2-5 MHz. Existen tres abordajes diferentes (Figura 4 y 5): Figura 4 Principales ventanas sonográficos para el estudio del diafragma. A la izquierda imagen obtenida con sonda sectorial 2-5 MHz, utilizando ...
Antes de publicarse, todas las opiniones de Tripadvisor pasan por un sistema automático de seguimiento, el cual recopila información que responde a las siguientes cuestiones: cómo, qué, dónde y cuándo. Si el sistema detecta que algo no cumple nuestras directrices de la comunidad, la opinión no se publicará.
Elektrostal , lit: Electric and Сталь , lit: Steel) is a city in Moscow Oblast, Russia, located 58 kilometers east of Moscow. Population: 155,196 ; 146,294 ...
Show more. 12 places sorted by traveler favorites. 1. Electrostal History and Art Museum. 19. Art Museums • History Museums. 2. Statue of Lenin. 16.
Elektrostal Geography. Geographic Information regarding City of Elektrostal. Elektrostal Geographical coordinates. Latitude: 55.8, Longitude: 38.45. 55° 48′ 0″ North, 38° 27′ 0″ East. Elektrostal Area. 4,951 hectares. 49.51 km² (19.12 sq mi) Elektrostal Altitude.